|
|
肿瘤的分型(classification)、分级(grading)和分期(staging)是目前评价肿瘤生物学行为和诊断的最重要的三项指标,其中分级和分期主要用于恶性肿瘤生物学行为和预后的评估。近数十年来,得益于生命科学和医学技术的突破性进展,肿瘤个体化治疗相关靶标的检测及包括靶向治疗在内的个体化治疗药物的临床应用,不仅在很大程度上提高了早期肿瘤的检出率,也明显改善了许多肿瘤的预后。传统肿瘤分型、分级和分期的临床价值和意义也随之产生不同程度的变化。
分型:肿瘤从什么细胞变化过来的,就是说我看肿瘤恶性程度的时候,得知道和哪种正常细胞进行比对。分级:就是肿瘤与正常细胞的差异程度,主要就是通过肿瘤细胞的分化程度来决定的,分化越高,恶性程度越低。分级和分型是为了确定用药情况的,因为得知道他是什么细胞过来的,分化到什么程度了(这个分化程度就是分级),如果还知道亚型,就可以进行靶向治疗(就是精准医疗)。分型和分级是为了更好的确定分期,分期是最重要的点。分期:主要就是确定这个肿瘤本身够不够大,另外有没有扩散,扩散到哪了,严重程度如何,这就是分期。分期一般使用TNM分期方式,一般数值越大,表明情况越糟糕,实际的预后越差。确定好分期,你就知道肿瘤在哪,该用什么药,再综合考虑病人的经济情况,年龄等因素,就能得到具体的治疗方案是什么。肿瘤分期通常只针对于恶性肿瘤。它是一个评价体内恶性肿瘤的数量和位置的过程。肿瘤分期是根据个体内原发肿瘤以及播散程度来描述恶性肿瘤的严重程度和受累范围。了解疾病的程度,可以帮助医生制定相应的治疗计划并且了解疾病的预后和转归。同时肿瘤分期也为医生在讨论患者的病情时提供了一种通用的语言。另外详细的了解疾病的分期信息也有助于为具体患者制定更为有针对性的临床试验方案。
既往认为,TNM分期是反映恶性肿瘤进展、判断预后的独立指标,亦是决定手术切除范围、手术方式和合理辅助治疗方案的主要依据,而肿瘤的组织学类型和分级的临床价值并不明确。然而,实际情况并非如此,恶性肿瘤组织学类型和分级对其侵袭转移能力和肿瘤预后的影响正被逐步认识:如前所述,肿瘤的分型和分级是肿瘤的内在本质特征:肿瘤的分型依赖于肿瘤组织细胞与正常组织细胞的形态相似性,肿瘤的分级取决于肿瘤来源组织的分化程度,均是反映肿瘤来源组织细胞的分化程度、结构特征和生物学行为等内在特征重要参数。肿瘤的分期以原发肿瘤的大小及浸润范围、局部淋巴结及远隔脏器、组织受累范围为判读依据,是反映肿瘤侵袭转移能力的临床可观察参数。肿瘤的TNM分期不仅取决于特定的肿瘤组织学类型(或分子表型)和分化程度,同时受到患者就诊时间的显著影响。
简而言之,肿瘤的分型描述的是肿瘤的来源,肿瘤的分级描述的是肿瘤的分化程度,而肿瘤的分型和分级决定了不同类型肿瘤特有的生物学行为和侵袭转移能力,进而决定了肿瘤的TNM分期。TNM分期反映的是恶性肿瘤的进展程度、预示的患者到达预期生命终点的时间点。因此,加强恶性肿瘤组织学分型、分级和免疫表型的研究是准确判断肿瘤进展程度、预后、制定临床治疗方案的之关键。
然而,随着分子生物学技术的发展,基因测序、荧光原位杂交、免疫组化、Real-time PCR等技术的广泛应用和后基因组学时代(post-genenomic era)的来临,对于肿瘤的认识已经深入到分子水平。基因突变、缺失或过表达以及染色体不稳定性 (chromosomal instahility,CIN)、微卫星不稳定(microsatellite instability,MSI)等遗传学机制和CpG 岛甲基化(The CpG Island Methylator phenotype,CIMP)、蛋白磷酸化等表遗传学机制得以阐明,一系列肿瘤个性化治疗相关分子靶标被先后发现,大量特异性肿瘤靶向治疗药物也陆续上市,不仅为恶性肿瘤的预后预测和指导治疗提供了新的指标、也在一定程度上为恶性肿瘤的治疗提供新的方案,还在不同层面上改变着传统肿瘤病理分型、分级、分期的临床意义和患者的预后。例如,高度恶性的低分化或未分化结直肠癌由于出现MSI-H而显示良好的临床经过,表皮生长因子受体(EGFR)高表达及KRAS、BRAF等基因突变的结直肠癌患者由于采用靶向治疗药物和新辅助治疗方案,预后也较前明显改善。Her-2基因的检测和赫赛丁的使用完全改变了Her-2阳性乳腺癌患者的预后。
可见,肿瘤个体化治疗时代业已来临,传统肿瘤分型、分级和分期已经不能满足肿瘤个体化治疗的需要,因此,在传此基础上,提升肿瘤分子分型诊断水平,为肿瘤的个体化治疗提供更为精确的分子生物学信息、指导个体化治疗方案的制定和疗效监测,无疑将是恶性肿瘤分型、分级和分期的发展方向和目标。(个体化治疗)
总之,肿瘤的分型、分级和分期是评价肿瘤生物学行为和侵袭转移能力及临床进展程度的重要参数,其中肿瘤的分型和分级是反应肿瘤来源及其生物学行为和侵袭转移能力的内在参数,肿瘤的分期是反映肿瘤侵袭转移能力和临床进展程度的可检测指标,不仅取决于肿瘤的组织学类型和分级,同时明显受制于患者临床症状和就诊时间。在传统肿瘤分型、分级和分期的基础上,积极开展以肿瘤特异性分子靶标的检测为核心的分子分型诊断是精确、客观预测肿瘤预后、指导治疗方案的制定和疗效监测的前提和基础,对于肿瘤个体化治疗的实施具有重要意义。
<hr/>恶性肿瘤的病理分类(分型)
尽管,关于肿瘤起源的干细胞理论和去分化理论的争论仍在持续,但是,机体各器官和组织、细胞均可发生肿瘤的事实却不可否认。肿瘤细胞与其来源组织的相似或接近于正常组织的程度是肿瘤病理学分类(分型)的重要诊断依据,例如,角化型鳞癌出现不成程度的角化、腺癌具有分泌功能、黑色素瘤能够合成黑色素、滑膜肉瘤具有双向分化特征等等。因此,肿瘤的病理学分型是最能反映肿瘤来源组织细胞的生物学行为和形态学特征的重要参数。
不同组织类型的肿瘤具有不同的生物学行为和侵袭转移能力,例如,来源于消化道的粘液性癌粘液性癌(印戒细胞癌或粘液癌)较管状腺癌更易于发生淋巴结转移、预后更差,而乳腺粘液癌预后良好。
而从肿瘤细胞分化层面讲,低分化肿瘤较高分化肿瘤具有更强的侵袭转移能力、恶性程度更高 (在肿瘤病理报告单上,常能见到高分化、中分化或低分化的字样,这是肿瘤病理学上的常用术语,用来表示肿瘤的恶性程度。低分化癌与未分化癌肿瘤组织与正常组织相差很大,成熟度差,恶性度高。高分化,即肿瘤细胞的分化程度接近正常细胞,提示恶性程度低。)。
目前,WHO肿瘤分型标准是公认的肿瘤分型方案,通常按照优势成份分型原则进行恶性肿瘤的分型,即以肿瘤主要组织学类型(>50%的组织结构)进行分型诊断。然而,异质性(heterogeneity)是恶性肿瘤的重要组织结构特点之一,许多恶性肿瘤(如结直肠癌和胃癌等)均存在不同程度的多方向分化或不同组织学类型并存的现象,肿瘤的异质性也决定了恶性肿瘤复杂的临床生物学行为和预后。显然,按照优势成份分型原则进行的WHO肿瘤分型方法无疑会在某种程度上忽视恶性肿瘤高度异质性的组织学特征,也掩盖了次要组织性类型对肿瘤生物学行为和预后的影响;同时,病理组织学诊断也易受恶性肿瘤千差万别的显微镜下形态学表现以及病理医师主观因素判断的影响,不可避免存在一定的分型不一致性。此外,即使相同分型、分级和分期的肿瘤,由于其分子表型的差异,显示出完全不同的治疗反应和预后。
可见,按照优势原则进行的恶性肿瘤分型方案在反映肿瘤组织学特征、生物学行为和预后方面均存在一定的局限性,并不能满足肿瘤个体化治疗中对于肿瘤诊断精细化的要求。因此,在传统肿瘤病理学分型的基础上,大力推进以肿瘤分子表型检测为核心肿瘤的分子分型诊断迫在眉睫。
<hr/>肿瘤的分级
分化(cell differentiation)是指从胚胎时的幼稚细胞逐步向成熟的正常细胞发育的过程。肿瘤细胞分化是指肿瘤细胞逐渐演化成熟的过程。异型性(atypia)是恶性肿瘤的重要组织学特征,其实质是肿瘤分化程度的形态学表现,反映的是肿瘤组织在组织结构和细胞形态上与其来源的正常组织细胞间不同程度的形态差异。这种肿瘤组织异型性的大小可用肿瘤的分级(grading,G)来表示。(就是与其来源的正常细胞间的差异,这就是分级)
为什么需要亚型,因为即使相同分型、分级和分期的肿瘤,由于其分子表型的差异,显示出完全不同的治疗反应和预后。大多将肿瘤分为1-4级(有些分级系统是分为1-3级),分别用G1、G2、G3和G4表示。
- Ⅰ级(G1):肿瘤细胞和组织看起来最像健康的细胞和组织,称为分化良好的肿瘤。肿瘤被认为是低级别的,恶性程度低。
- Ⅱ级(G2):肿瘤细胞和组织有些异常,看起来不像正常的细胞和组织,并且比正常的细胞生长更快,称为中度分化的肿瘤。肿瘤被认为是中等级别的,恶性程度相对较高。
- Ⅲ级(G3):肿瘤细胞和组织看起来非常异常,称为低分化的肿瘤。肿瘤被认为是高等级的,恶性程度更高。
- IV级(G4):肿瘤细胞和组织看起来最异常,称为未分化的肿瘤。这类肿瘤被认为是最高等级的,恶性程度最高,生长和扩散更快。
- GX,表示医生无法评估等级,也称为未定等级。
在实际操作中,肿瘤的分级主要是根据显微镜下HE染色切片中肿瘤组织结构和细胞异型性的大小、核分裂像或增殖指数的多少、坏死范围、侵袭状况等参数确定的。并以分化最好的区域来确定肿瘤的组织学来源(分型),而以分化最差的区域来确定肿瘤的级别(确定分型的方法),可见,恶性肿瘤的分级反映的是肿瘤的内部特征,对于客观评估肿瘤的分化程度和生物学行为、预测预后具有很大参考价值。一般说来,肿瘤分级越高,预后越差,但并非完全一致。
然而,由于肿瘤组织结构的复杂性和异质性特征,不同类型肿瘤(例如腺癌、鳞癌、肾细胞癌、乳腺癌等等)均有其不同的结构特征和分级标准,且缺乏定量指标,此外,由于受取材充分程度和对诊断标准、异型性判读的主观性差异的影响,均不同程度地影响到肿瘤分级的客观性、精确性和可重复性。
因此,精简分级参数、减少分级的级别、简化分级标准,增强可量化参数和临床可操作性及可重复性,是肿瘤分级的必然趋势。在过去的几十年来,得益于不同领域的专家学者的卓越贡献,在此取得显著进展。例如,在上皮内瘤变分级中将3级简化为高低两个级别的分级理念无疑为肿瘤组织学分级提供了值得借鉴的成功经验。而核分裂、增殖指数(如Ki-67)等的检测为恶性肿瘤的诊断和分级提供了可靠的可量化参数,其中Ki67作为评价肿瘤细胞增殖活性的可量化参数,在肿瘤分级中的价值也日益被接受并广泛应用。此外,Gleason等按腺体结构异型性提出的前列腺癌Gleason评分系对于前列腺癌的分级也提供了一种较为合理的可量化分级方案,并被广泛使用。免疫学评分进行的肿瘤分类也为量化分型与分级提供了新的方法。
<hr/>肿瘤的分期
肿瘤的分期(staging)是根据原发肿瘤的大小、浸润的深度、范围以及是否累及邻近器官、有无局部和远处淋巴结的转移、有无血源性或其他远处转移等参数来确定的,其实质是反映肿瘤的侵袭转移程度,是评价恶性肿瘤侵袭转移范围、病程进展程度、转移和预后的重要指标。精确的肿瘤分期不仅是准确预测恶性肿瘤生物学行为及预后的可靠指标,也能为临床医师提供准确的患者分层管理依据,还是选择辅助治疗方案、提高治疗效果的基本前提。
在众多肿瘤分期方案1929年的Dukes分期中,由美国癌症联合会(The International American Joint Committee on Cancer (AJCC))提出的TNM分期系统(TNM staging system)是目前被广泛接受和公认的能够反映恶性肿瘤进展、判断预后的最可靠的独立指标。 2010年,第七版 TNM staging (AJCC-7) 也已出版。
众所周知,恶性肿瘤的生物学行为和侵袭转移能力取决于其特定的组织学类型(或免疫表型)和分化程度,也就是说肿瘤的组织学类型(或免疫表型)和分化程度是真正影响TNM分期的决定性因素。因此,深入探讨恶性肿瘤的组织学分型(或免疫表型)和分级、全面检测肿瘤侵袭转移范围才是精确进行TNM分期的根本。
与肿瘤组织学分型与分级是肿瘤内在的特征参数不同,肿瘤的分期是描述肿瘤特征的外部参数,不仅取决于肿瘤的组织学类型和分级,还明显受到肿瘤所引发的临床症状出现的早晚、患者的临床耐受性、患者经济状况、医疗保障水平和患者就诊时间等主观和社会因素的影响。可见,患者就诊时间在相当大程度上也决定了肿瘤的TNM分期。
基本因素
原发(初始)肿瘤的部位;肿瘤的大小和数量;淋巴结的受累情况(肿瘤是否已经侵及邻近的淋巴结组织);是否存在转移病灶(肿瘤是否已经播散至体内的远隔部位);另外脑和脊髓来源的肿瘤是根据细胞的类型和级别进行分期的;还存在一些特别的分期系统对应血液系统和骨髓系统肿瘤,例如淋巴瘤;一些国家和地区也存在相对于某种疾病的独立分期,例如日本关于胃癌的分期等等。
分期方法
(一) 物理诊断:
物理诊断可能为医生提供相关线索了解肿瘤的位置,大小以及是否已经侵及淋巴结组织,和/或累及其他器官。例如在消化道肿瘤的分期中,直肠的肛门指诊就是一项非常重要的物理检查手段,对于直肠癌或是肛管肿瘤可能提供很多有关原发肿瘤的相关信息。对于胃癌病例特别是女性患者,可能提供有关于盆腔受累的重要信息。
(二) 影像学检查:
影像学检查手段可以提供原发肿瘤位置,受累和播散情况的相关信息,是决定肿瘤分期的重要检查方法。随着医学科技进展,大量的先进技术应用于影像学检查中。目前主要用于肿瘤分期的手段包括放射线检查(X-ray ,)超声检查(ultrasound),核磁共振(MRI,magnetic resonance imaging),计算机断层扫描(CT,computed tomography),内窥镜检查(endoscope)以及广泛应用的正电子发射成像(PET,positron emission tomography)。
(三) 实验室检查:
实验室检查用以分析从患者体内得到的血液,尿液和其他体液组织。也可以提供很多肿瘤的相关信息。特别是一些具有高特异性的肿瘤相关标记产物的检查。
(四) 病理检查:
病理报告的信息包括肿瘤的大小,是否侵及其他组织和脏器,肿瘤细胞的类型,肿瘤的分化程度(反映肿瘤细胞与正常组织的相似程度)。通过对于切除的肿瘤或是通过内窥镜等手段获得组织切片在显微镜下的观察可以为确诊肿瘤和肿瘤的准确分期提供帮助。
(五) 外科手术记录:
手术记录有助于了解术中的具体发现,肿瘤的大小,外观,并且可以和影像学等检查互为参考,并且可以提供有关于淋巴结和其他器官受累的直观信息。
肿瘤分期的作用和意义有哪些?
肿瘤分期也是一种语言,便于医生与医生之间有共同的科学的评估体系,也便利于医患沟通以及患者和患者之间的沟通,分期的作用和意义主要如下:
- 1、判断病人预后(存活的机会和时间):总体上讲,处于同一种分期期别里的病人,其大致的自然生存期是比较一致的。病人的分期越晚,生存时间相对越短。从I期到IV病人,存活的时间越短。
- 2、了解治疗方式的疗效和成果:只有同样的癌症种类和分期的患者,才能比较迄今为止都有哪些治疗方式可以选择,各自的疗效如何,才能对以后病人的治疗给出有根据的最好的治疗建议。
- 3、对治疗的效果进行预测:确定分期,选择适合的特定的治疗方式,就可预判治疗的效果,如有效率是多少,平均的存活时间是多长,并可预估治疗的副作用都有哪些。
- 4、选择合适的治疗方法:不同的分期对应着不同的治疗方式或治疗方式的组合,只有明确了分期,才能在多种治疗方法中确定合适的治疗方式和策略。
- 5、比较同一种癌症病情的轻重:癌症病友会经常谈论各种各样的治疗方式,尤其是打听到治疗效果好的新的治疗方式时,都想问是否适合自己。然而,所有的治疗方式均对应特定的病情的病期,很多情况下,病情病期的判断需要专业的医生来完成,因而对新的治疗方式的打听,最好还是咨询专业的肿瘤医生。
为什么又要把TNM分期分为临床分期cTNM和病理分期pTNM呢?
再以恐怖分子扩散为例说明如下,如果我们判断恐怖分子的扩散范围是根据对人群的观察、摄像头监控(类似与医生体检和拍摄CT片子)和朝阳群众举报(类似活检穿刺)范围判断恐怖分子扩散范围的,这种情况的判断不会特别精确,但也是一个常用的、比较可行的方法。这种情形类似于肿瘤的临床分期。临床分期是医生通过临床检查,影像学检查,实验室检查,细胞穿刺活检等手段确定肿瘤的分期。
但如果我们能通过一定手段,在恐怖分子核心安插内线,通过他们来获得内部的情报,那么我们的信息和情报就会精确很多。这种情形类似于肿瘤的病理分期。病理分期是医生通过给病人手术治疗,肿瘤的性质通过病理学证实,侵犯范围通过手术探查确定。一般来讲病理分期pTNM较临床分期cTNM更为准确,但很多时候病理分期不可获得,一如打入恐怖分子内部代价高昂、困难重重且常常不可能一样。
那么肿瘤的“分子分期”是怎么回事?
对手术或者穿刺活检的肿瘤标本,除了发现癌症细胞来确诊肿瘤外,我们还可以对癌细胞里面的蛋白和基因等分子进行检测,蛋白一般用免疫组化的方法,基因用一些分子生物学的方法,检测的这些指标有些也是和靶向药物等治疗方式的选择,以及病人的预后生存时间是有关系的,这就是所谓的分子诊断后的“分子分期”。
不同的分期的癌症治疗策略肯定不同,对吗?
是的,不同分期肿瘤的治疗策略是不同的(对不同范围的恐怖分子的打击的策略肯定是不同的)。这也是肿瘤为什么要分期的主要原因。如果以肺癌为例,不同的期别,治疗方法和策略图示如下:(特别说明的是手术是肺癌重要的治疗方法,然而IIIB期肺癌就不应该接受手术治疗,否则癌症扩散加剧。强调一下,违犯了治疗原则,病人会一步错步步错,最佳的治疗机会白白丧失,造成不可挽回的治疗损失,治疗效果也就大打折扣了!!)

肿瘤分期会变吗?
一名患者的肿瘤分期所指的是其在初次诊断、治疗前的肿瘤分期,该分期不会随着肿瘤的发展而改变,即便是患者在接受治疗后肿瘤复发了或癌细胞扩散至其他部位。在一些非常罕见的情况下,医生会对在缓解期后复发的恶性肿瘤进行再次分期(restaging),在记录新分期时会在TNM分期值前写上”r”字母,以表达再分期的意思。
值得一提的是,并不是所有癌症都使用TNM分期,因为某些癌症的生长与扩散方式不一样,无法用TNM去定义,包括脑部和脊髓肿瘤、部分儿童肿瘤、霍奇金淋巴瘤和淋巴瘤以及血液系统其他肿瘤。此外,国际妇产科联盟(International Federation of Gynecologists and Obstetricians, FIGO)为妇科肿瘤专门制定了一套分期系统,但FIGO分期与TNM分期十分相似,便于临床医生对两个分期系统进行互相转换。肝癌的是TNM分期和巴塞罗那分期。
类型
(一) 临床分期(clinical staging):
通过物理诊断,影像学检查,病理活检等手段得到肿瘤分期的信息。临床分期往往是在医生在对于患者在接受治疗前,进行诊断时所做出的。很多肿瘤的治疗不仅仅依靠手术,手术前的治疗作为标准治疗方案应用于多种肿瘤。那么相对准确的术前临床分期对于临床医生筛选需要接受术前治疗的病例提供了重要信心。例如直肠癌治疗已经步入了以手术为主综合治疗的新阶段。新辅助治疗的出现尽管对于远期生存的影响还不明确,但选择性提高了括约肌保留率,并且减少了局部复发率。准确的术前临床分期有助于选择合适的患者接受术前新辅助治疗,避免过度治疗(overtreatment)或是治疗不足(undertreatment)的情况。
(二) 病理分期(pathological staging):
只能针对于接受手术切除肿瘤或者探查肿瘤的病例。并且病理分期是综合了临床分期和手术结果所做出的。它对于判断患者的预后和制定术后辅助治疗的策略至关重要。
内容
TNM分期系统是目前国际上最为通用的分期系统。首先由法国人Pierre Denoix于1943年至1952年间提出,后来美国癌症联合委员会(AJCC,American Joint Committee on Cancer)和国际抗癌联盟(UICC,the International Union Against Cancer)逐步开始建立国际性的分期标准,并于1968年正式出版了第1版《恶性肿瘤 INM分类法》手册,每隔6~8年更新一次,以纳入国际医学研究者自分期研究所得出的新结论。他已经成为临床医生和医学科学工作者对于恶性肿瘤进行分期的标准方法。
TNM分期系统是基于肿瘤的范围,TNM分期系统中:
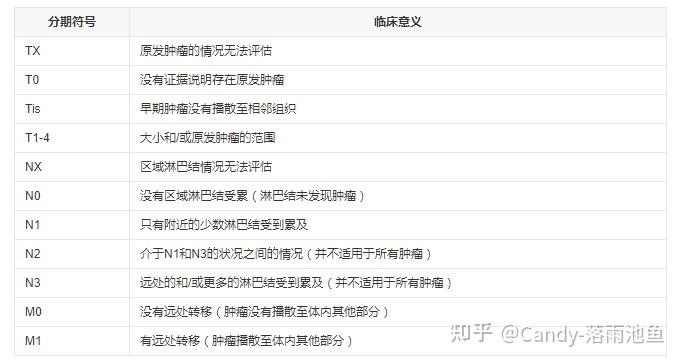
- 1,T(“T”是肿瘤一词英文“Tumor”的首字母)指肿瘤原发灶的情况,随着肿瘤体积的增加和邻近组织受累范围的增加,依次用T1~T4来表示;
- 2, N(“N”是淋巴结一词英文“Node”的首字母)指区域淋巴结(regional lymph node)受累情况。淋巴结未受累时,用N0表示。随着淋巴结受累程度和范围的增加,依次用N1~N3表示;
- 3,M(“M”是转移一词英文“metastasis”的首字母)指远处转移(通常是血道转移),没有远处转移者用M0表示,有远处转移者用M1表示。在此基础上,用TNM三个指标的组合(grouping)划出特定的分期(stage)。
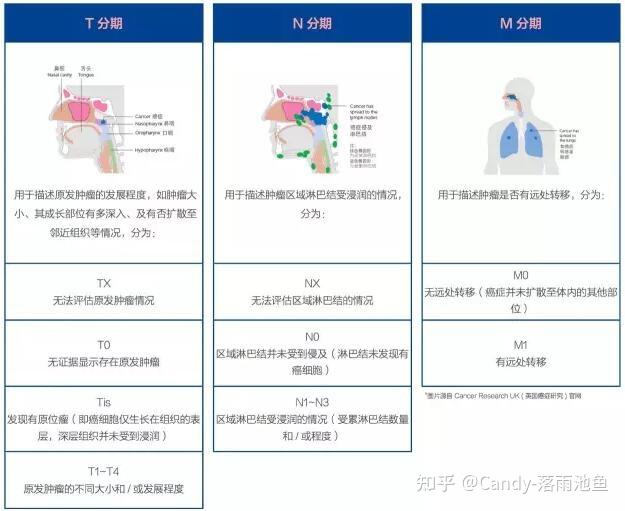
其中,淋巴结检测对于恶性肿瘤分期的精确性具有直接的影响,获得足够淋巴结是保证分期精确的前提。所以,在AJCC第七版TNM分期中对于不同肿瘤推荐了进行可靠分期所需的最少淋巴结数量,例如,对于结直肠癌推荐至少10-14 淋巴结才能进行可靠的淋巴结分期. 虽然,不同肿瘤TNM分期中T、N、M判读界值不尽相同,但,一般而言,数字越大,病情越晚,预后越差。
每一种恶性肿瘤的TNM分期系统各不相同,因此TNM分期中字母和数字的含义在不同肿瘤所代表的意思不同。TNM分期中T,N,M确定后就可以得出相应的总的分期,即I期,II期,III期,IV期等。有时候也会与字母组合细分为IIa或IIIb等等。I期的肿瘤通常是相对早期的肿瘤有着相对较好的预后。分期越高意味着肿瘤进展程度越高。
引自
肿瘤分期_百度百科
TNM分期系统_百度百科
肿瘤的分型、分级和分期_mjiansun的博客-CSDN博客_tnm分期
SFHZ 尚方慧诊:一文读懂肿瘤病理分期:早/中/晚期或I/II/III/IV期
三分钟读懂肿瘤分期的含义
什么是肿瘤的分级和分期,有啥区别?一文带您了解_腾讯新闻 |
|