|
|
撰文︱彭导灵,宋 波
责编︱王思珍,方以一
不同于烧杯中的化学反应,生命系统能够以高效率、低能耗、高精准地实现物质合成、能量转化及信息传递过程。对此,经典的化学反应理论难以提供合理的解释。生命系统都由基本粒子组成,而基本粒子的性质需要由量子力学描述,因此量子理论有望为经典理论不能解释的生命现象提供全新的机制。
烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide,NAD+)是生命体系中一种非常重要的辅酶分子,它参与了多种代谢途径,例如葡萄糖代谢、脂肪酸代谢和氨基酸代谢等。此外,NAD+还参与了一些细胞信号转导途径,例如DNA修复和细胞凋亡等。在生命体的有氧呼吸过程中,NAD+参与了线粒体的三羧酸循环[1](tricarboxylic acid,TCA),辅助细胞高效地产生能量货币三磷酸腺苷(adenosine triphosphate,ATP)。该过程具有较高的能量转换效率,其机制仍不完全清楚。因此迫切需要生命科学、化学和量子物理等领域进行进一步的跨学科研究。
近期,来自上海理工大学的宋波课题组联合华南师范大学及中国科学院上海应用物理研究所的科研人员在国际知名期刊Neuroscience Bulletin发表了题为“Mid-infrared Photons Released by NAD+ Reduction in the Tricarboxylic Acid Cycle of Myelinated Neuron”的研究论文。该研究从理论上揭示了细胞内存在内源中红外光子,即:NAD光子,由三羧酸循环中NAD+分子参与的还原反应产生。传统理论认为生物化学反应及过程是由热能驱动。该研究认为NAD+在参与TCA循环过程中会释放87THz的中红外光子,此中红外光子可以与神经元的髓鞘相干共振(coherent resonance)耦合形成混合量子态以保证其稳定存在,从而实现比热能更高的能量转换、利用效率。

在过去的几十年里,人们在植物、细菌和动物中都发现了光生物过程中的能量高效转化和利用现象。例如,植物的光合作用对光能的利用达到了~95%的效率[2],人类视觉达到了单光子分辨水平[3],这些现象显示生物系统中存在高效率的光子捕获和能量转化机制。近期实验表明,ATP水解可以释放频率为~34±2太赫兹(THz)的中红外(MIR)光子,即ATP光子,共振驱动DNA复制[4]。进一步的研究发现35.2THz的光照可以驱动DNA的折纸组装[5],为前面ATP光子实验提供了进一步的支持。除此之外,光还被用于高效率、高特异性地控制生物活动。例如,光遗传研究发现低功率(~5 mW/mm2)的光照就可以有效地控制生物分子活动[6];约1 mW/mm2的53.7 THz中红外光可以无视蛋白依赖、非热、可逆地调控钾离子通道活动、神经元信号传导以及感觉运动行为[7],甚至激活皮层神经元、加速联想学习[8]。这些事实表明,大多数生物能源的高效转化和利用可能与光有关,特别是中红外光。
最近研究显示,光生物过程的高效率与光子-物质混合量子态(a hybrid quantum state of light and matter)密切相关。植物光合作用中,可见光可以与叶绿体中叶绿素激子相干共振耦合,产生光-激子的混合量子态,从而实现了高效率的光能捕获及转化[9]。神经髓鞘中,中红外光和髓鞘磷脂分子相干共振耦合形成混合量子态,用于神经元的光能捕获,从而增强神经生物活性[10]。光子-物质混合量子态对化学反应也有影响。微腔化学反应研究显示,中红外光-分子的混合态可以有效地控制分子反应活性[11]。这些进展为理解生命系统的高效率能源利用现象开辟了一条新途径。
不同于传统观点(即:TCA循环产生的大部分能量是热量),该研究认为在有髓鞘神经元的TCA循环中,NAD+还原反应过程可以释放中红外光子,称为NAD光子(图1A),可被髓鞘捕获以提高神经元的能量利用效率。具体来说,神经元轴突的线粒体中,TCA循环的每一次氧化脱羧,即NAD+形成新C-H键以生成NADH的过程,都会产生频率为~87THz的NAD光子。之后,NAD光子被轴突髓鞘的磷脂分子相干共振吸收,进而与髓鞘形成混合量子态,有效地阻止了生物光子的耗散,从而提高了NAD+能量的利用效率。
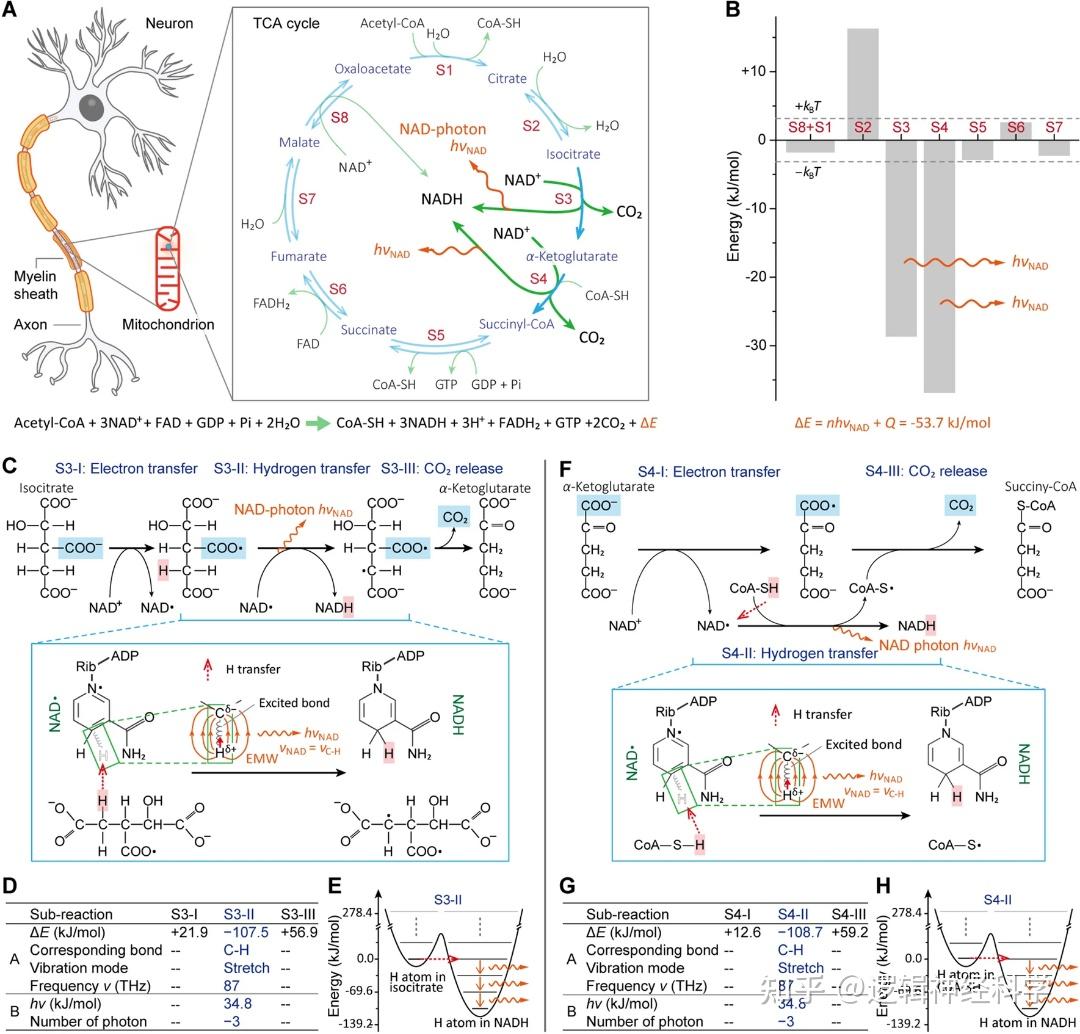
图1、髓鞘神经元线粒体中TCA循环的能量分析。正号、负分别表示能量吸收、能量释放。
典型的TCA循环包括八个步骤(标记为S1-S8)(图1A),能量分子NAD+参与了S3、S4和S8的生化反应,通过还原反应释放其化学能[1]。S1到S8反应能量变化的量子化学计算结果(图1B)显示,TCA循环的第S3和S4步可释放能量、产生NAD光子。具体来讲,在TCA循环的子反应S3-II和S4-II中,氢原子转移到NAD自由基形成NADH的过程会产生NAD光子(图1C-H)。
上述反应中产生的部分能量可能被TCA循环本身利用。通过分析TCA循环的能量变化可以确定每个循环净释放的NAD光子数量n = 2,即:TCA总能量变化包括两个NAD光子以及剩余热能。
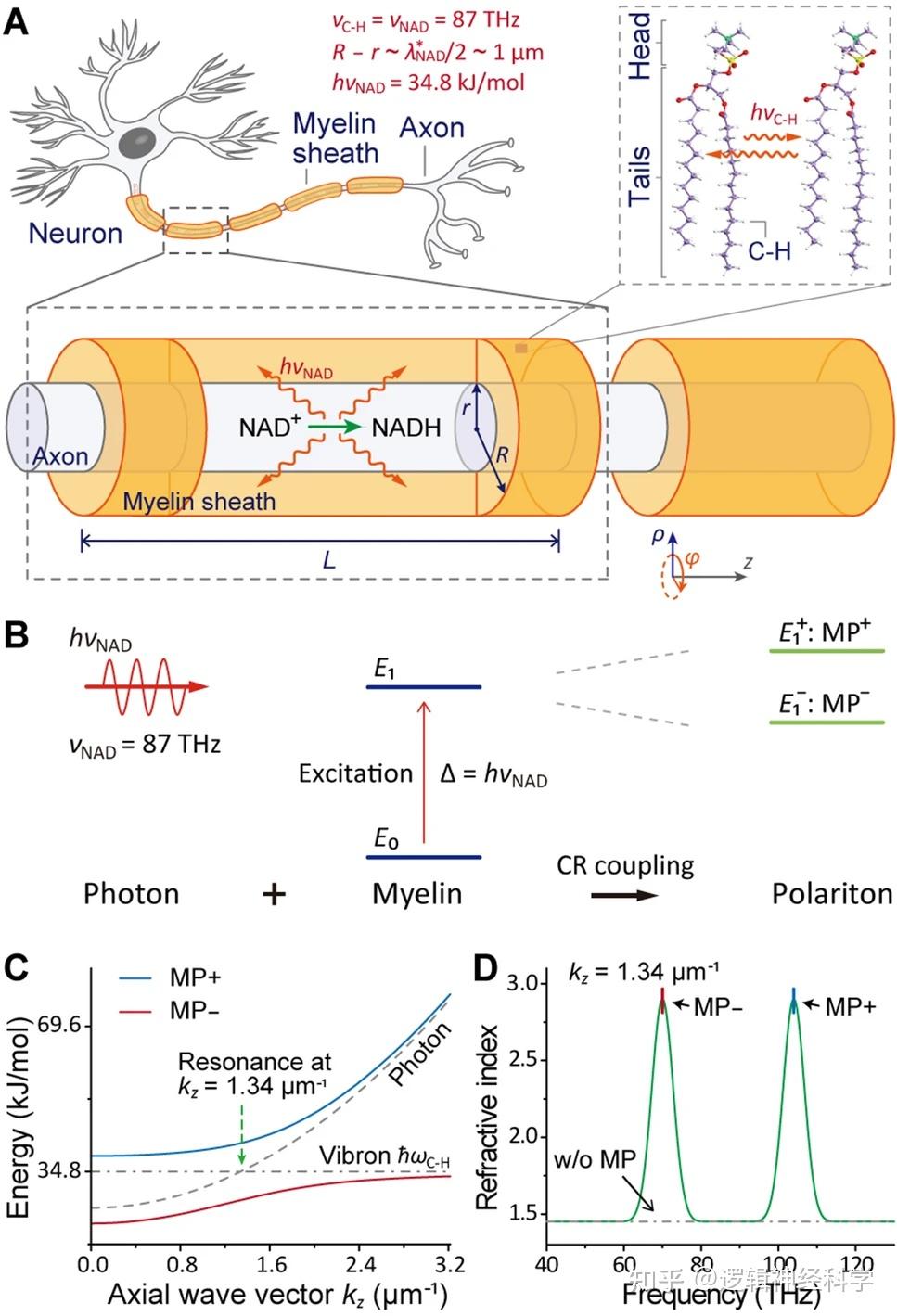
图2、神经元髓鞘通过光-髓鞘混合量子态捕获NAD光子。
NAD光子能否很好的被神经捕获及利用呢?在体温条件下,有髓神经元中可形成NAD光子和髓鞘的混合量子态。包裹轴突的髓鞘主要由富含C-H键的磷脂分子组成,并且C-H伸缩振动的频率约为87THz,与NAD光子的频率相同(图2A 左上)。因此,轴突线粒体中NAD+还原反应释放的光子很容易被轴突髓鞘的C-H键共振吸收(图2A 右上),从而激发C-H键的振动。之后,振荡弛豫释放出与C-H键频率相同的光子,这些光子再次被其它C-H键共振吸收。该吸收-发射-吸收过程发生在髓鞘内的任何地方。髓鞘由有序堆叠的磷脂双分子层构成,具有生物“晶体”的特征,髓鞘厚度与NAD光子的半波长相当[10]。因此,NAD光子可能与髓鞘中所有C-H振动产生集体相干。为了定量研究这个复杂过程,根据髓鞘特征,引入了一个圆柱形微腔模型来描述髓鞘。进一步的量子模型计算分析表明,髓鞘微腔中驻波光子和C-H振子的相干共振耦合可以导致混合量子态(图2B),该量子态称为髓鞘极化子(myelin polariton,MP),其色散关系如下:
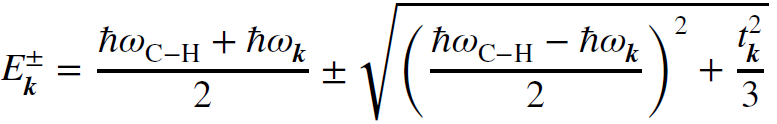
公式中的加号和减号表示MP的上分支和下分支,分别标记为MP+和MP-,即Rabi分裂能级[11]。MP沿轴向波矢量的色散如图2C所示,MP-在共振点处的能量下降了6.8kJ/mol,明显大于体温下的热波动(~3kJ/mol),表明NAD光子-髓鞘的混合量子态能够在体内存在。光子-髓鞘混合量子态的形成可以引起髓鞘对NAD光子的束缚效应(confinement effect)。在光子与髓磷脂C-H键的共振点,MP-(70THz)和MP+(104THz)的折射率可以达到2.90(图2D),明显高于没有MP的髓鞘折射率(~1.45)以及外部生理溶液的折射率(~1.37)。因此,髓鞘中很容易发生全内反射,从而束缚相关光子。即:虽然髓鞘本身的折射率很低,无法有效束缚NAD光子,但是光子、髓鞘相干共振耦合产生的MP可以显著提高髓鞘的折射率,为捕获NAD光子提供良好条件,提高NAD能量的利用效率。
综上所述,基于量子化学计算和量子物理模型分析提出了TCA循环中NAD+的还原过程可以释放出频率为~87THz的NAD光子;髓鞘可以相干共振地捕获这些光子,形成光子-髓鞘混合量子态(MP),提高神经元的能量利用效率。值得注意的是,该混合量子态同时包含了髓鞘及NAD光子的特征,可以承载神经信息。两个相邻髓鞘由郎飞结(Ranvier's node)连接。郎飞结的大小约为1-2μm,明显小于MP量子态的波长,为髓鞘之间的MP量子隧穿提供了可能性,从而实现MP沿轴突传输。平行的两个髓鞘可通过富含磷脂双分子层的神经胶质细胞连接,有望导致MP的横向耦合,实现平行神经元之间的信息交换。上述分析表明,NAD光子和髓鞘的混合量子态有望成为神经信息载体,为高效率的神经能量利用、信息传输提供量子物理角度的理解。
此外,细胞内还有许多由磷脂双分子层组成的结构,如:内质网、高尔基体、线粒体嵴等。它们也可能与NAD光子发生相干共振耦合,形成新的混合量子态。这些量子态有望提高细胞的能量利用效率,甚至调控细胞内的生物过程、生化反应。
原文链接:https://link.springer.com/article/10.1007/s12264-023-01044-7
华南师范大学环境学院彭导灵研究员和中国科学院上海应用物理研究所亓文鹏博士为本文共同第一作者,上海理工大学光电信息学院宋波教授为本文通讯作者。该工作得到了国家重点研发计划、国家自然科学基金的大力支持。
转载须知:“逻辑神经科学”特邀稿件,本内容著作权归作者和“逻辑神经科学”共同所有,欢迎个人转发分享,未经授权禁止转载,违者必究。

参考文献(上下滑动查看)
[1] Nelson DL, Cox MM. Lehninger Principles of Biochemistry, 5th edn W.H. Freeman & Co., New York, 2008.
[2] Pullerits T, Sundstrӧm V. Photosynthetic light-harvesting pigment-protein complexes: toward understanding how and why. Acc Chem Res 1996, 29: 381–389.
[3] Tinsley JN, Molodtsov MI, Prevedel R, Wartmann D, Espigulé-Pons J, Lauwers M, Vaziri A. Direct detection of a single photon by humans. Nat Commun 2016, 7: 12172.
[4] Yang Y, Peng D, Gu Z, Jiang L, Song B. AuNP-modulated qPCR: an optimized system for detecting MIR biophotons released in DNA replication. Chem Eur J 2023, 29: e202203513.
[5] Zhang C, Yuan Y, Wu K, Wang Y, Zhu S, Shi J, Wang L, Li Q, Zuo X, Fan C, Chang C, Li J. Driving DNA origami assembly with a terahertz wave. Nano Lett 2022, 22: 468–475.
[6] Boyden ES, Zhang F, Bamberg E, Nagel G, Deisseroth K. Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci 2005, 8: 1263–1268.
[7] Liu X, Qiao Z, Chai Y, Zhu Z, Wu K, Ji W, Li D, Xiao Y, Mao L, Chang C, Wen Q, Song B, Shu Y. Nonthermal and reversible control of neuronal signaling and behavior by midInfrared stimulation. Proc Natl Acad Sci U S A 2021, 118: e2015685118.
[8] Zhang J, He Y, Liang S, Liao X, Li T, Qiao Z, Chang C, Jia H, Chen X. Non-invasive, opsin-free mid-infrared modulation activates cortical neurons and accelerates associative learning. Nat Commun 2021, 12: 2730.
[9] Chen YC, Song B, Leggett AJ, Ao P, Zhu X. Resonant confinement of an excitonic polariton and ultraefficient light harvest in artificial photosynthesis. Phys Rev Lett 2019, 122: 257402.
[10] Song B, Shu Y. Cell vibron polariton resonantly self-confined in the myelin sheath of nerve. Nano Res 2020, 13: 38–44.
[11] Nagarajan K, Thomas A, Ebbesen TW. Chemistry under vibrational strong coupling. J Am Chem Soc 2021, 143: 16877–16889.
编辑︱王思珍
本文完

|
|