|
|
肿瘤相关巨噬细胞(TAM,Tumour-associated macrophages)是肿瘤微环境(TME,Tumor Microenvironment)的重要组成部分,在血管生成、细胞外基质重塑、癌细胞增殖、转移和免疫抑制的协调以及对化疗药物和检查点阻断免疫疗法的耐药性中发挥作用。相反,巨噬细胞也可以介导癌细胞的吞噬作用和细胞毒性肿瘤杀伤,并与先天性和适应性免疫系统的组成部分进行有效的双向相互作用。因此,TAM已成为癌症治疗的治疗靶点。本期为大家揭开肿瘤相关巨噬细胞的神秘面纱。
巨噬细胞是什么?
巨噬细胞是高度可塑性的细胞,根据不同的信号经历各种形式的功能激活。巨噬细胞分为两种形式的巨噬细胞活化,通常称为M1和M2。M1巨噬细胞可能在体外由1型T辅助细胞和先天淋巴细胞驱动的1型免疫应答期间产生的细菌产物和干扰素诱导,而M2巨噬细胞是由2型T辅助细胞和先天淋巴细胞驱动的2型免疫应答期间产生的细胞因子(如IL-4和IL-13)诱导的。M1极化与巨噬细胞依赖性组织损伤和肿瘤细胞杀伤有关,而M2极化促进组织修复和重塑以及对寄生虫的抵抗力。在体内,在几种炎症状况或组织损伤中,观察到巨噬细胞活化的动态变化,经典活化的M1细胞与引发和维持炎症有关,而M2或M2样细胞与慢性炎症的消退有关。然而,一般来说,具有不同表型的混合表型或群体共存,这表明M1/M2分类对于这种转录动态细胞类型过于简单。
巨噬细胞起源何处?
直到几年前,人们还认为组织驻留巨噬细胞(TRM,Tissue-resident macrophage)完全起源于源自骨髓造血干细胞的血液单核细胞,这些单核细胞不断被募集到组织中并分化成组织特异性巨噬细胞群。小鼠的命运图谱研究完全改变了对TRM个体发生的看法。在稳态条件下,循环单核细胞仅在特定组织(如真皮,肠和心脏)中对组织巨噬细胞做出贡献,并且这种贡献随着年龄的增长而增加。在其他组织中,如皮肤、大脑、肝脏或肺,巨噬细胞群来源于源自卵黄囊和胎肝的胚胎前体,并在胚胎发生过程中浸润这些组织,然后在整个成年期局部复制。因此,皮肤中的朗格汉斯细胞、脑中的小胶质细胞、肝脏中的库普弗细胞和肺中的肺泡巨噬细胞独立于成人骨髓细胞维持自身。其他组织包含两种来源的巨噬细胞,胚胎和骨髓衍生,其频率取决于组织和病理状况。在稳态条件下,特别是在感染或炎症时,成体骨髓来源的细胞被招募到组织中并取代胚胎巨噬细胞,经历基因重编程并获得与胚胎起源对应物的相似性。事实上,组织特异性巨噬细胞群的特征在于不同的转录特征和表观遗传标记,这是由特定的组织因素决定的。在癌症的背景下,协调这种可塑性的信号在不同肿瘤之间或同一肿瘤的不同部分和阶段之间差异很大,导致不同的TAM表型(图1)。
肿瘤细胞来源的细胞因子,如IL-10、CSF1和CCL2、CCL18、CCL17、CXCL4等趋化因子,是促肿瘤模式下TAM功能可塑性的关键启动子。TAM的“M2样”极化是指与肿瘤促进和抑制有效适应性免疫相关的功能程序。影响巨噬细胞极化的新兴因素是由活化的B淋巴细胞意外分泌的神经递质γ-氨基丁酸(GABA)。GABA可以促进单核细胞分化为产生IL-10的抗炎巨噬细胞并抑制细胞毒性CD8 T细胞。小鼠和人类肿瘤中TAM的单细胞分析揭示了单核吞噬细胞簇的复杂情况,远远超出了原始简单的M1/M2分类。
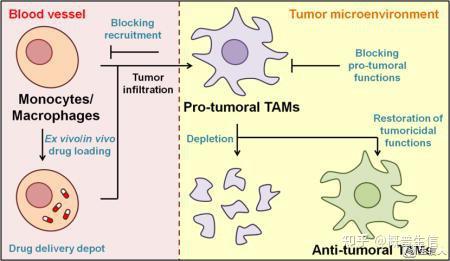
图1 TAM的起源与肿瘤微环境中的作用
巨噬细胞在癌症转移中的作用
血源性和淋巴途径是癌细胞播散的主要途径。小鼠模型研究表明,巨噬细胞是血源性播散和转移的重要组成部分,通过与癌细胞、细胞外基质以及先天性和适应性免疫系统的其他组成部分相互作用来影响这一多步骤过程的所有步骤。在乳腺癌发生的小鼠模型中,发现巨噬细胞通过促进血管生成为转移性传播铺平了道路,为转移性扩散到肺部和在继发性癌症沉积物中的积累提供了生态位,由趋化因子CCL2触发的趋化因子级联反应驱动炎性单核细胞的募集及其作为转移相关巨噬细胞保留。在同一模型中,巨噬细胞也参与促进骨转移,驱动巨噬细胞M2极化的IL-4受体(IL-4R)对于巨噬细胞介导的骨转移促进至关重要。淋巴系统是许多肿瘤的主要播散途径。在移植的乳腺癌模型中,发现表达PDPN的TAM亚群介导细胞外基质的重塑、淋巴管生成和淋巴细胞侵袭,为癌细胞的播散的“帮凶”。
TAM在常规癌症治疗中的应用
巨噬细胞在不同抗癌方式的活性中具有重要的双重作用,包括化疗、放疗、抗血管生成和激素治疗以及免疫检查点阻断(ICB)免疫治疗。一些选定的化疗药物(如阿霉素)诱导肿瘤抗原和佐剂分子的释放使巨噬细胞参与富有成效的癌症免疫周期,这一过程称为免疫原性细胞死亡。TAM耗竭对于抗肿瘤活性至关重要。特定的抗癌药物可以逆转TAM极化,从而增加对治疗的反应,例如吉西他滨治疗胰腺癌,5-氟尿嘧啶治疗结直肠癌以及铂类新辅助化疗治疗高级别卵巢癌。对于通过产生活性氧(ROS)诱导DNA损伤的药物,例如基于铂类的化学疗法,肠道微生物组可以启动肿瘤内单核吞噬细胞以产生ROS,从而积极调节这些药物的功效。在放疗的情况下放射后共生细菌和真菌的作用相反,真菌的消耗增强了乳腺癌和黑色素瘤小鼠模型中对辐射的反应性,在这种情况下,巨噬细胞通过抗癌治疗促进适应性免疫反应的激活而起作用。因为TAM分泌以VEGF为主的积极响应血管生成的生长因子,TAM的密度通常与肿瘤组织中血管的密度相关。因此,抗血管生成治疗的活性由TAM调节。VEGF拮抗剂诱导血管正常化并同时重塑TAM表型,而髓系细胞通过组织蛋白酶B和血管生成素2等代偿途径介导对抗血管生成治疗的耐药性。
TAM和ICB免疫疗法
T细胞介导的1型免疫反应是ICB免疫疗法的基石(图2)。骨髓单核细胞是免疫抑制回路的主要协调因子,是ICB反应的重要决定因素,并且对这种治疗的耐药性至关重要。骨髓单核细胞表达几种免疫抑制分子,包括检查点配体,如PDL1,PDL2,CD80(也称为B7-1)和CD86(也称为B7-2)和脊髓灰质炎病毒受体(PVR,也称为CD155和TIGIT配体之一),这是对ICB的原发性和适应性抵抗的肿瘤外在途径的一部分。PDL1免疫组化评估被批准作为NSCLC和其他肿瘤抗PD1治疗的伴随诊断,但其预测能力可能因所考虑的细胞类型而异,例如肿瘤或免疫细胞。在临床前模型中,PDL1在肿瘤浸润免疫细胞上的表达与抗PD1或抗PDL1的反应有关。出乎意料的是,巨噬细胞表达PD1,这与它们对肿瘤细胞的吞噬活性呈负相关。
组织质地在决定巨噬细胞在ICB中的作用方面很重要。例如,在三阴性乳腺癌中不同的骨髓细胞谱,包括中性粒细胞和巨噬细胞,介导了对ICB的耐药性。肝转移中的肝巨噬细胞通过消除T细胞负调节对全身免疫治疗的反应,胸膜腔和腹膜腔代表免疫抑制微环境中肿瘤进展的部位。在小鼠模型和患者中,TIM4+巨噬细胞抑制CD8 T细胞反应并抑制ICB,用抗体阻断TIM4可增强ICB在这些位点的疗效。在人肾细胞癌中,M2样巨噬细胞的优势与ICB的耐药性有关,对免疫治疗的反应可以通过微生物组的组成进行调节,如抗CTLA4和抗PD1,其中肠道细菌的丰度和多样性形成肿瘤骨髓浸润。巨噬细胞的耗竭可以增强各种免疫治疗策略,包括疫苗接种和检查点抑制剂。最新研究显示几项结合检查点抑制剂和抗CSF1R抗体或其他以TAM为中心的治疗策略的临床试验正在进行中。
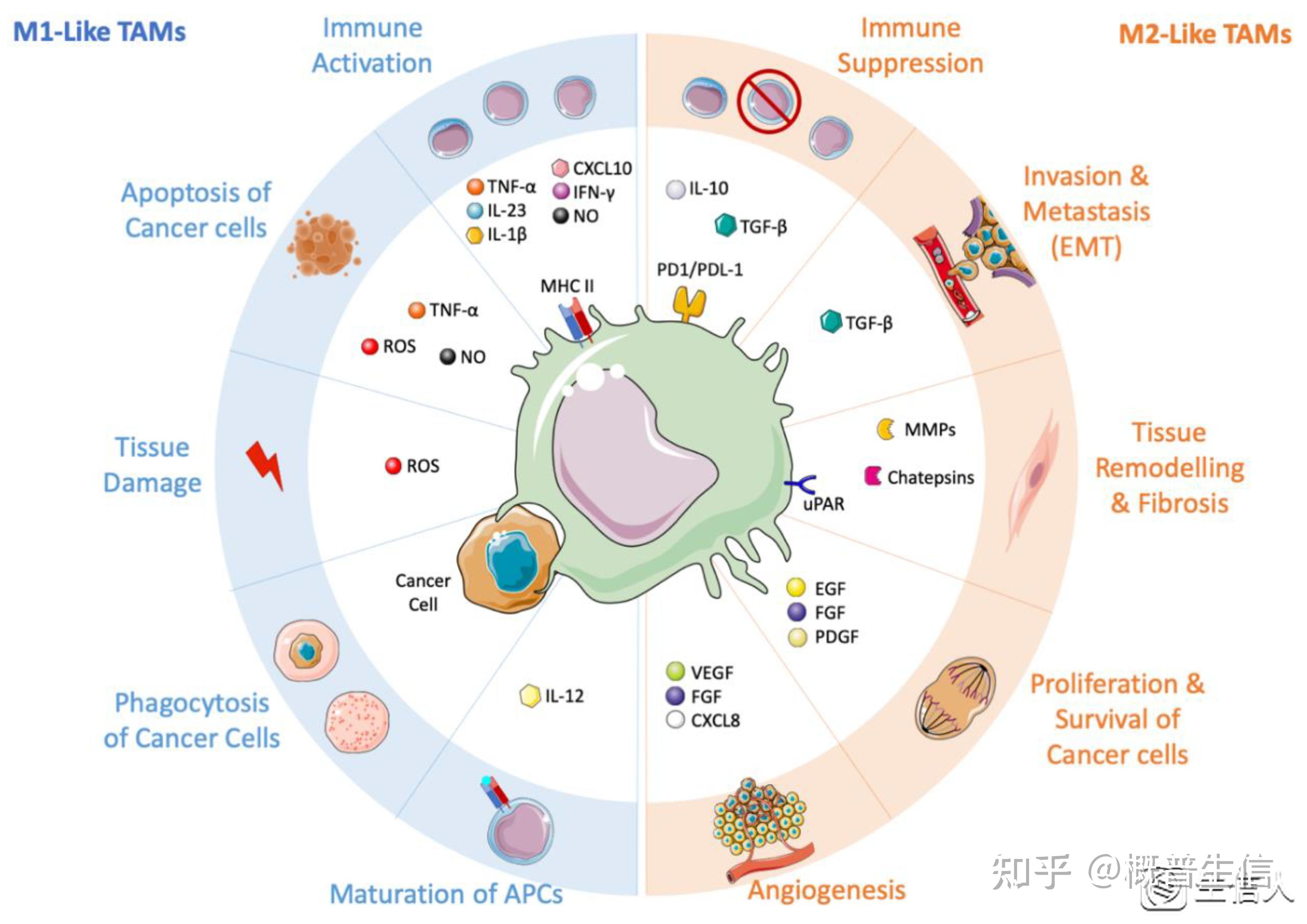
图2 TAM的功能全解
分析思路干货
TAM对于肿瘤发生发展、转移、免疫微环境状态均有重要作用,一个可能的研究思路:
(1)整合公共数据库中的单细胞测序数据,分离并解析各肿瘤组织中的TAM;
(2)聚类分析区分TAM细胞状态亚群,研究不同状态的TAM对肿瘤细胞特征的贡献,从而定义出TAM亚群特征signature;
(3)在实体瘤中分析TAM与其它细胞类型的相互作用,包括肿瘤细胞和其它类型的免疫细胞;
(4)将TAM signature 应用到TCGA等公共数据库进行肿瘤分型,鉴定TAM状态对肿瘤患者预后(对治疗方式的敏感性、生存期等)的影响。
Reference
1.Mantovani A, Allavena P, Marchesi F, Garlanda C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 2022 Nov;21(11):799-820. doi: 10.1038/s41573-022-00520-5. Epub 2022 Aug 16. PMID: 35974096; PMCID: PMC9380983.
2.DeNardo DG, Ruffell B. Macrophages as regulators of tumour immunity and immunotherapy. Nat Rev Immunol. 2019 Jun;19(6):369-382. doi: 10.1038/s41577-019-0127-6. PMID: 30718830; PMCID: PMC7339861.
3.Park MD, Silvin A, Ginhoux F, Merad M. Macrophages in health and disease. Cell. 2022 Nov 10;185(23):4259-4279. doi: 10.1016/j.cell.2022.10.007. PMID: 36368305. |
|