|
|
近年来,随着对各类血液肿瘤疾病发病机制研究的不断深入,作用于相关通路和靶点的新药也层出不穷,迎来了蓬勃发展。
2022年也即将步入尾声,在这一年中有许多血液肿瘤药物获批上市,截至今日,中国共有8款新药获批,美国FDA共批准了10款新药,其中包括热门的CAR-T疗法、各类靶向双抗和单抗以及ADC药物等多种药物疗法,覆盖了多个血液肿瘤类型(包括白血病、滤泡细胞淋巴瘤、多发性骨髓瘤、大B细胞淋巴瘤以及霍奇金淋巴瘤等等类型),为许多患者带来了新的治疗选择!
血液肿瘤篇 国内获批药物大盘点
外周T细胞淋巴瘤
● 全球首个米托蒽醌脂质体药物获批上市,外周T细胞淋巴瘤二线治疗再增“新武器”!
2022年1月7日,盐酸米托蒽醌脂质体注射液(多恩达®)获得国家药品监督管理局(NMPA)批准,用于既往至少经过一线标准治疗的复发或难治外周T细胞淋巴瘤(PTCL)成人患者[1]。
↓ 点击下图了解更多 ↓

关于多恩达®治疗PTCL患者II期临床研究数据:客观缓解率达41.7%!多恩达(盐酸米托蒽醌脂质体注射液)关键II期临床研究[2]结果显示:
- 其在复发/难治性外周T细胞淋巴瘤(R/R PTCL)患者中的客观缓解率(ORR)为41.7%,完全缓解率(CR)为23.1%;
- ≥3个月的DoR比率为84.4%,最长中位持续缓解时间(DoR)为19.45个月;
- 无进展生存期(PFS)为8.5个月,中位OS(总生存期)为未达到,最长OS为26.4月(54例仍在OS随访中),6个月的OS率为75%,9个月的OS率为68.2%。
白血病
● 国内首个IDH1抑制剂——艾伏尼布片获批,临床研究显示36.7%患者达完全缓解!
2022年1月30日,首款异柠檬酸脱氢酶-1(IDH1)抑制剂——艾伏尼布片(拓舒沃®)正式获得国家药品监督管理局(NMPA)的上市批准,用于治疗中国IDH1突变复发或难治性急性髓系白血病(R/R AML)患者,将有望开辟中国IDH1突变R/R AML治疗新格局[3]。
↓ 点击下图了解更多 ↓

拓舒沃®的获批是基于一项中国注册桥接研究CS3010-101[3],该研究旨在评估拓舒沃®口服治疗携带IDH1易感突变的成人R/R AML中国患者的药代动力学特征、药效动力学特征、安全性和临床疗效。
研究结果显示:
- 在30例可评估患者中,主要疗效终点完全缓解及部分血液学恢复(CR/CRh)率为36.7%【11/30,11例患者均达到了完全缓解(CR)】;
- 总体中位总生存期(OS)为9.1个月,达到CR/CRh患者的中位OS尚未达到;
- 并且安全性良好,未发现非预期的不良事件,特别关注的不良事件发生比例未见高于AG120-C-001研究。
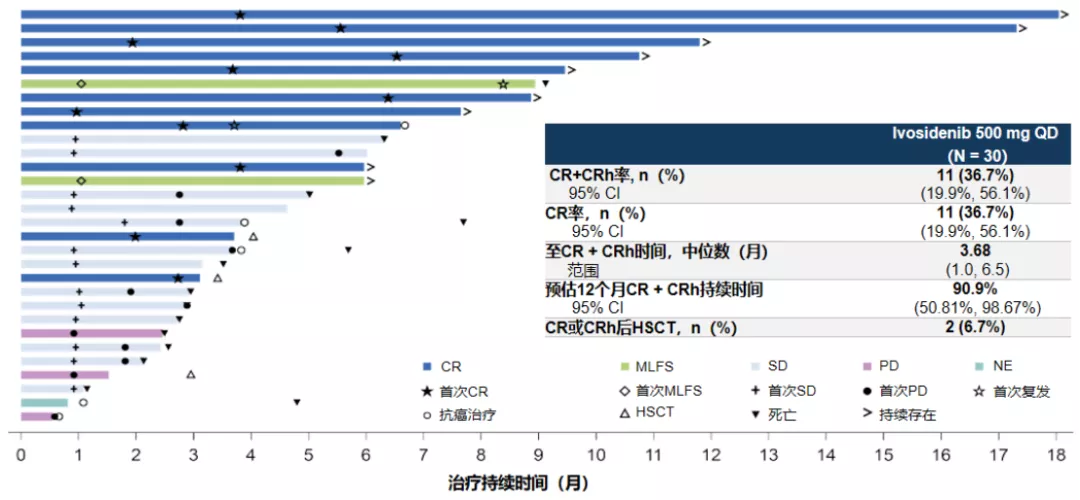
<艾伏尼布治疗持续时间和最佳客观缓解>
● 全球“First-in-class”创新药——贝林妥欧单抗注射液,国内获批儿童R/R B-ALL适应症!
2022年4月27日,全球首个CD3-CD19双特异性抗体——贝林妥欧单抗(倍利妥®)获得国家药品监督管理局(NMPA)附条件批准,用于治疗儿童复发或难治性(R/R)前体B细胞急性淋巴细胞白血病(B-ALL)[4]。
↓ 点击下图了解更多 ↓
此前倍利妥®获得附条件批准用于治疗成人复发或难治性CD19阳性前体B细胞ALL患者,是基于在中国境外开展的临床试验数据,以及在中国针对成人患者开展的3期临床试验(NCT03476239)的分析结果。而此次其获得附条件批准用于治疗这一适应症的儿童人群,是基于在中国境外开展的研究数据以及中国成人患者的临床数据[4]。
贝林妥欧单抗获国内外权威指南推荐!
美国国立综合癌症(NCCN)指南中,对于首次早期或晚期复发、造血干细胞移植后首次复发以及多次复发或难治的,以及强化巩固化疗后MRD阳性的B-ALL儿童患者,推荐使用贝林妥欧单抗[5]。在《中国临床肿瘤学会(CSCO)儿童及青少年白血病诊疗指南(2022版)》中,贝林妥欧单抗也被推荐用于 R/R B-ALL治疗[6]。
贝林妥欧单抗价格下调,降价3285元,减轻成人和儿童白血病患者负担!
在2022年9月6日,国家医保局公示了《2022年国家基本医疗保险、工伤保险和生育保险药品目录调整通过初步形式审查的申报药品名单》,通过名单可看到贝林妥欧单抗也已通过国家医保药品目录调整初步形式审查。同时为积极争取贝林妥欧单抗(倍利妥®)进入国家医保药品目录以及减轻ALL患者治疗负担,百济神州主动下调其价格,从12900元/瓶下调至9615元/瓶,降价3285元,降幅达25.5%。
我们也十分期待此药可以纳入医保,惠及多个白血病患者家庭。
霍奇金淋巴瘤
● 抗肿瘤新药——盐酸丙卡巴肼胶囊获批晚期霍奇金淋巴瘤!
2022年4月19日,盐酸丙卡巴肼胶囊(Natulan®)获得国家药品监督管理局(NMPA)批准,用于治疗晚期霍奇金淋巴瘤[7]。
↓ 点击下图了解更多 ↓
在中国进行的开放标签、随机、对照、多中心临床研究,当中比较基线BEACOPP【包括博来霉素、依托泊苷、盐酸阿霉素(阿霉素)、环磷酰胺、长春新碱(安可平)、丙卡巴肼及泼尼松的联合化疗】及ABVD【包括盐酸阿霉素(阿霉素)、博来霉素、长春碱及达卡巴嗪的联合化疗】治疗方案对晚期霍奇金淋巴瘤患者的安全客观缓解率。
研究结果[8]显示:
- 该项临床试验共有93名晚期霍奇金淋巴瘤患者入组,该项研究不仅与其主要最终目标匹配(即基线BEACOPP组别的客观缓解率不逊于ABVD组别);
- 并且在完成四个周期治疗后,基线BEACOPP组别(每个周期21日)患者的完全缓解率亦显着提高至16.22%(6/37),而ABVD组别(每个周期28日)则为2.17%(1/46)。
大B细胞淋巴瘤
● 中国自主研发抗CD20单抗——瑞帕妥单抗获批弥漫大B细胞淋巴瘤,联合CHOP和利妥昔单抗联合CHOP疗效相当,但安全性更优!
2022年8月23日,国家药品监督管理局(NMPA)正式批准新型抗CD20单抗瑞帕妥单抗——安平希®的新药上市申请,本次获批的适应症为联合CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)方案治疗弥漫性大B细胞淋巴瘤(DLBCL)[9]。
↓ 点击下图了解更多 ↓
2022年7月20日,瑞帕妥单抗关键注册III期临床试验线上发表于《Hematological Oncology》杂志 (IF=4.850),该研究比较了瑞帕妥单抗与原研利妥昔单抗联合CHOP治疗初治弥漫大B淋巴瘤(DLBCL)的疗效和安全性。该研究共纳入了364例初治DLBCL患者。
研究结果[10]显示:
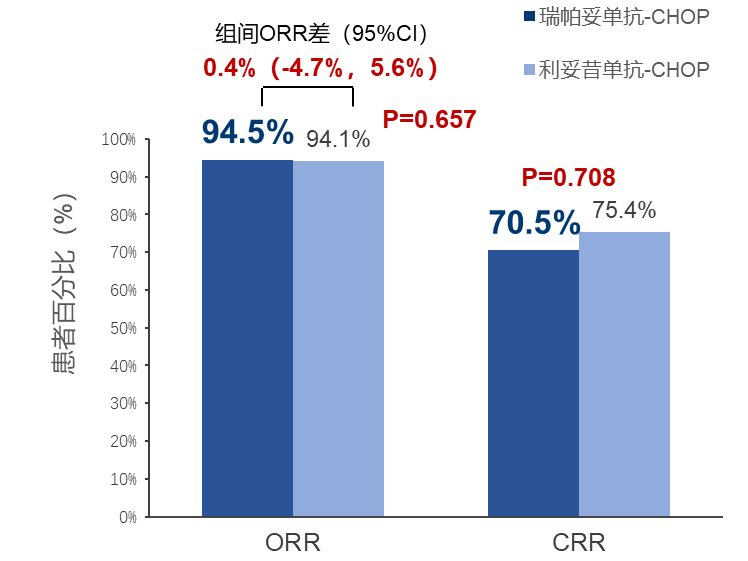
1.两组的客观缓解率(ORR)及完全缓解率(CRR)无显著差异。符合方案分析人群(PPS)中,独立影像学委员会(IRC)评估的的ORR,S-CHOP和R-CHOP组分别为94.5%和94.1%(p=0.6569);CRR分别为70.5%和75.4%(p=0.7084)。
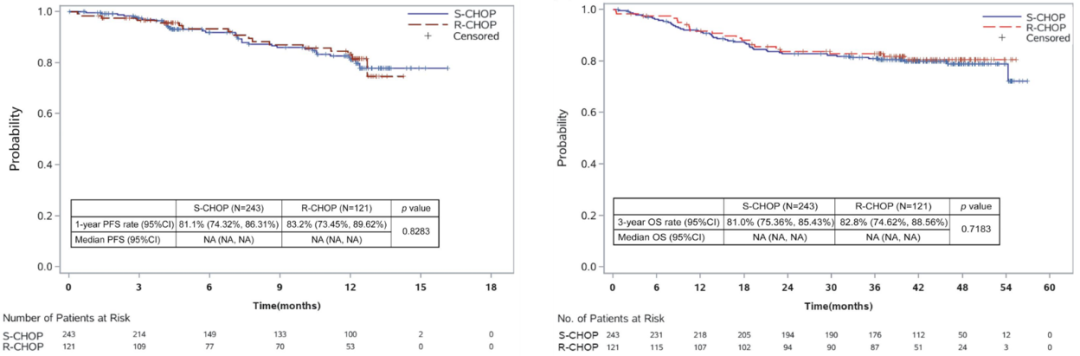
2.两组间的1年无进展生存期(PFS)和3年总生存期(OS)无显著差异。全分析人群(FAS)中,1年PFS率S-CHOP组和R-CHOP组分别为81.1%和83.2%(p=0.8283),3年OS率S-CHOP组和R-CHOP组分别为81.0%和82.8%(p=0.7183)。
3.安全性方面,瑞帕妥单抗-CHOP和利妥昔单抗-CHOP两组总体安全性相似。
故上述数据表明,瑞帕妥单抗联合CHOP治疗DLBCL疗效非劣于R-CHOP,且瑞帕妥单抗免疫原性更低,在某些安全性事件上有一定优势。
皮肤T细胞淋巴瘤
● 罕见淋巴瘤新药——国内首个抗CCR4抗体「莫格利珠单抗」获批两类皮肤T细胞淋巴瘤!
在2022年10月11日,国内首个靶向CCR4生物制剂——莫格利珠单抗注射液获国家药品监督管理局(NMPA)批准,用于既往接受过至少一次全身性治疗的蕈样肉芽肿(MF)或Sézary综合征(塞扎里综合症,SS)成人患者的治疗(这是两类常见的皮肤T细胞淋巴瘤)[11]。
↓ 点击下图了解更多 ↓

在MAVORIC的Ⅲ期临床研究[12]中,372名符合条件的患者被1:1随机分配接受莫加珠单抗(n=186)或伏立诺他(n=186),研究结果显示,与伏立诺他相比,接受莫格利珠单抗治疗时,血液受累程度较高的MF或SS患者观察到改善的预后。
- 分析显示,在研究者评估的无进展生存期(PFS)方面,与伏立诺他治疗组相比,莫格利珠单抗治疗组显著延长(7.7个月 vs 3.1个月;p<0.0001)。
- 在整个试验人群中,莫格利珠单抗治疗组总缓解率(ORR)也高于伏立诺他治疗组(28.0% vs 4.8%;p<0.0001)
- 下一次治疗时间(TTNT)方面,莫格利珠单抗治疗组与伏立诺他治疗组相比,在血液受累水平为B1(12.63 vs 3.07个月,p=0.0018)和B2(13.07 vs 3.53个月,p<0.0001)的患者中显著更长。
滤泡性淋巴瘤
● 全球首款PI3K-δ和PI3K-γ口服双重抑制剂「度维利塞胶囊」获批上市,临床研究显示客观缓解率高达95.2%!
2022年3月16日,度维利塞胶囊(克必妥®)获得国家药品监督管理局(NMPA)批准,用于治疗以往至少经过两次系统性治疗的复发或难治性滤泡性淋巴瘤(r/rFL)成年患者[13]。
↓ 点击下图了解更多 ↓

国内II期临床研究结果显示[14],
- 度维利塞在中国复发/难治滤泡性淋巴瘤患者人群中获得了更优越的疗效,客观缓解率(ORR)高达95.2%、完全缓解率(CR)52.4%;
- 中位无进展生存期长达18.86个月,给患者带来更长无病生存时间,中位缓解持续时间为17个月,让患者获得更好的生存质量,中位起效时间1.8个月,起效迅速;
- 与美国关键临床试验中呈现的安全性特征相近,未发现新的安全性信号,大部分治疗期间不良事件为低级别(1-2级),并且无受试者发生结局为死亡的不良事件。
● 中国首个高选择性PI3Kδ抑制剂林普利塞获批上市,中国II期研究结果显示,患者总缓解率达79.8%!
2022年11月8日,国家药品监督管理局(NMPA)通过优先审评审批程序附条件批准1类创新药林普利塞片(商品名:因他瑞)上市。该药为我国自主研发并拥有自主知识产权的创新药,适用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤(R/R FL)成人患者[15]。
↓ 点击下图了解更多 ↓

林普利塞为磷脂酰肌醇-3-激酶的δ亚型(PI3Kδ)选择性抑制剂,该药品的上市为经现有治疗手段治疗后复发难治的滤泡淋巴瘤成人患者提供了治疗选择[15]。
2022欧洲血液学协会(EHA)年会公布了林普利塞治疗R/R FL患者的中国II期临床试验的最新数据[16]。
该研究纳入了至少接受过2次全身治疗的R/R FL患者,接受林普利塞80mg治疗,口服,每日一次。结果显示:
- 患者总缓解率(ORR)为79.8%,疾病控制率(DCR)达96.6%,12个月总生存(OS)率为91.4%;
- 中位至缓解时间(mTTR)为1.9个月;中位无进展生存期(mPFS)为13.4个月,中位缓解持续时间(mDOR)为12.3个月。
- 安全性方面,林普利塞大多数不良反应可控,患者总体耐受性良好。
血液肿瘤篇 美国FDA获批药物大盘点
多发性骨髓瘤:点此了解最近研究结果
● 复发或难治性多发性骨髓瘤CAR-T细胞疗法ciltacabtagene autoleucel获批,研究结果显示客观缓解率可达97.9%!
2022年2月28日,美国食品药品监督管理局(FDA)批准了全球第二款靶向BCMA CAR-T ciltacabtagene autoleucel (cilta-cel,西达基奥仑赛,LCAR-B38M/JNJ-4528)用于治疗接受过≥4线治疗(包括蛋白酶体抑制剂[PI]、免疫调节剂[IMiD]和抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤(R/R MM)成人患者[17]。
↓ 点击下图了解更多 ↓

该批准基于CARTITUDE-1研究,这是一项开放标签的多中心临床试验,评估了cilta-cel在97例复发或难治性多发性骨髓瘤患者中的疗效。结果显示,客观缓解率(ORR)为97.9%(95% CI:92.7%,99.7%)。在95名缓解的患者中,中位随访时间为18个月,中位DOR为21.8个月(95%CI:21.8,NE)[17]。
● 针对RRMM的靶向BCMA/CD3双特异性抗体Tecvayli(teclistamab)获批上市,研究数据显示总缓解率(ORR)达61.8%!
2022年10月25日,美国食品药品监督管理局(FDA)授予teclistamab-cqyv(Tecvayli)加速批准,这是第一个获批的靶向BCMA/CD3双特异性抗体,用于既往接受至少四线治疗(包括蛋白酶体抑制剂、免疫调节剂和抗 CD38 单克隆抗体)的复发或难治性多发性骨髓瘤(RRMM)成年患者[18]。
↓ 点击下图了解更多 ↓

本次批准是基于I/II期MajesTEC-1试验 (NCT03145181;NCT04557098) 数据,该试验[18]显示:
- 独立审查委员会评估并采用2016年国际骨髓瘤工作组标准,teclistimab的总缓解率(ORR)为61.8%(95%CI,52.1%-70.9%)。
- 此外,在缓解者中位随访7.4个月时,药物在6个月时的估计缓解率持续时间 (DOR) 为90.6%(95%CI,80.3%-95.7%);在9个月时,该比率为66.5%(95%CI,38.8%-83.9%),尚未达到中位DOR(NE;95%CI,9.0-NE)。
大B细胞淋巴瘤
● FDA批准axicabtagene ciloleucel用于大B细胞淋巴瘤的二线治疗,疗效优于标准治疗!
2022年4月1日,美国食品药品监督管理局(FDA)批准了「axicabtagene ciloleucel」(Yescarta,简称Axi-Cel)用于一线化学免疫治疗难治性或一线化学免疫治疗后12个月内复发的大B细胞淋巴瘤(LBCL)成年患者。不适用于治疗原发性中枢神经系统淋巴瘤患者[19]。
↓ 点击下图了解更多 ↓

该批准基于ZUMA-7研究,该研究是一项针对原发难治性LBCL或完成一线治疗后12个月内复发的成人患者的随机、开放标签、多中心试验。主要疗效指标为独立审查委员会(IRC)确定的无事件生存期(EFS)[19]。
- Axi-Cel组的EFS显著延长,风险比为0.40(95%CI:0.31,0.51;分层p值<0.0001)。Axi-Cel组和标准治疗组的预估18个月EFS率分别为41.5%(95%CI:34.2,48.6)和17.0%(95%CI:11.8,23.0)。预估的中位EFS分别为8.3个月(95%CI:4.5,15.8)和2.0个月(95%CI:1.6,2.8)。
- 在随机接受标准治疗的患者中,35%接受了方案内自体HSCT;化疗无效是未接受HSCT的最常见原因。
- Axi-Cel组IRC评估的最佳客观缓解率在统计学上显著高于标准治疗组:分别为83%(95%CI:77,88)和50%(95%CI:43,58)。
● 靶向CD19 CAR-T疗法 Liso-cel获批新适应症!应用于大B细胞淋巴瘤的二线治疗!
2022年6月24日,美国食品药品监督管理局(FDA)批准Lisocabtagene maraleucel(Liso-cel)用于对一线化学免疫疗法难治或一线化学免疫治疗12个月内复发;或对一线化学免疫疗法难治或一线化学免疫治疗后复发,且由于合并症或年龄不适合进行HSCT的大B细胞淋巴瘤(LBCL)成人患者,不适用于治疗原发性中枢神经系统淋巴瘤患者[20]。
↓ 点击下图了解更多 ↓

TRANSFORM研究是一项随机、开放标签、多中心试验,对原发难治性LBCL或一线治疗达到完全缓解(CR)后12个月内复发的成人患者进行了疗效评估。
研究结果[20]显示:
- Liso-cel组的无事件生存期(EFS)显著更长,风险比(HR)为0.34(95% CI:0.22, 0.52;p值<0.0001)。
- Liso-cel组和标准治疗组的估计1年EFS率分别为45%(95% CI: 29, 59)和24%(95% CI: 14, 35),估计的中位EFS分别为10.1个月(95% CI:6.1,不可评估)和2.3个月(95% CI:2.2, 4.3)。
白血病
● 儿童罕见白血病迎来新疗法——FDA 批准阿扎胞苷用于新诊断的幼年型骨髓单核细胞白血病!
2022年5月20日,美国食品药品监督管理局(FDA)批准阿扎胞苷(Azacitidine)用于治疗新诊断的幼年型粒单核细胞白血病(JMML)儿科患者[21]。
幼年型粒单核细胞白血病(JMML)是一种罕见的儿童早期恶性克隆性疾病,2022年世界卫生组织公布的第5版血淋巴肿瘤分类已将其归入骨髓增殖性肿瘤(MPN)。JMML预后很差,多数患者生存期低于2年,被称为“儿童白血病之王”[22]。
↓ 点击下图了解更多 ↓

AZA-JMML-001研究(NCT02447666)是一项国际、多中心、开放标签研究,旨在评估18名JMML儿科患者在造血干细胞移植(HSCT)前接受阿扎胞苷治疗的药代动力学、药效学、安全性和活性。主要疗效结果为在3个月时(第3周期,第28天)的临床完全缓解(cCR)或临床部分缓解(cPR)(根据国际JMML缓解标准)。缓解必须持续至少4周。
共有9名患者(50%, 95%CI: 26, 74)确认临床缓解。在这9名患者中,有3名cCR和6名cPR。中位至缓解时间为1.2个月(范围:0.95-1.87个月)。接受HSCT的患者比例为94%,至HSCT的中位时间为4.6个月(范围:2.8-19个月)[21]。
● 延长患者生存期3倍!FDA批准艾伏尼布联合阿扎胞苷用于治疗新诊断急性髓系白血病患者!
2022年5月25日,美国食品药品监督管理局(FDA)批准艾伏尼布(ivosidenib)联合阿扎胞苷用于新诊断的具有易感IDH1突变的急性髓系白血病(AML)患者[23]。
↓ 点击下图了解更多 ↓

该批准基于一项随机、多中心、双盲、安慰剂对照研究(AG120-C-009,NCT03173248)。
研究结果[23]显示:
- 艾伏尼布+阿扎胞苷组和安慰剂+阿扎胞苷组患者的EFS(无事件生存期)事件发生率分别为65%和84%(HR 0.35;95% CI:0.17,0.72,p=0.0038)。
- 艾伏尼布+阿扎胞苷组的中位总生存期(OS)为24.0个月(95% CI:11.3, 34.1),安慰剂+阿扎胞苷组的中位OS为7.9个月(95% CI:4.1, 11.3)(HR 0.44;95% CI:0.27, 0.73;p=0.0010)。
- 艾伏尼布+阿扎胞苷组的完全缓解(CR)率为47%(95% CI:35%,59%),安慰剂+阿扎胞苷组的CR率为15%(95% CI:8%,25%)。艾伏尼布+阿扎胞苷组(95% CI:13.0,NE)的中位CR持续时间不可估计(NE),安慰剂+阿扎胞苷组的中位CR持续时间为11.2个月(95% CI:3.2,NE)。
● IDH抑制剂市场再添一员!急性髓系白血病新药olutasidenib获批上市!
2022年12月1日,美国食品药品监督管理局 (FDA) 批准将olutasidenib(Rezlidhia)胶囊用于有易感IDH1突变的复发性或难治性急性髓系白血病(AML)成人患者。同天,FDA还批准了Abbott RealTime IDH1检测法,用于选择olutasidenib的患者[24]。
↓ 点击下图了解更多 ↓

该批准基于研究2102-HEM-101(NCT02719574),这是一项开放标签,单臂,多中心临床试验,包括147名使用上述测定确认IDH1突变的复发或难治性AML成年患者。
研究结果[24]显示:
- 携带IDH1突变的复发或难治性AML成人患者中,完全缓解(CR)加完全缓解伴部分血液学(CRh)缓解率为35%,其中CR为32%,CRh为2.7%。
- CR+CRh的中位时间为1.9个月(范围:0.9-5.6个月);中位缓解持续时间为25.9个月(95%CI:13.5个月,未达到)。
滤泡性淋巴瘤
● 靶向CD19 CAR-T细胞疗法tisagenlecleucel获批用于成人淋巴瘤,总缓解率(ORR)达86%!
2022年5月27日,美国食品药品监督管理局(FDA)加速批准tisagenlecleucel(Kymriah)用于治疗≥2线系统治疗后的复发或难治性滤泡性淋巴瘤(R/R FL)成人患者[25]。
↓ 点击下图了解更多 ↓

该批准是基于多中心、单臂、开放标签的ELARA研究(NCT03568461),该研究评估了靶向CD19 CAR-T细胞疗法tisagenlecleucel治疗FL患者(在完成≥2线治疗后6个月内难治或复发[包括抗CD20单抗或烷化剂]或自体造血干细胞移植后复发)的疗效和安全性[25]。
主要疗效指标是由独立审查委员会确定的总体缓解率(ORR)和缓解持续时间(DOR)。
- 在主要疗效分析的90名患者中,总缓解率(ORR)为86%(95% CI: 77, 92),完全缓解(CR)率为68%(95% CI: 57, 77)。
- 中位DOR未达到,75%(95% CI: 63, 84)的缓解患者在9个月时仍处于缓解中。对于所有接受白细胞分离术的患者(n=98),ORR为86%(95% CI: 77, 92),CR率为67%(95% CI: 57, 76)。
FGFR1重组或重排的髓系性/淋巴样肿瘤
● 首款获批的精准疗法!FDA批准Pemazyre用于FGFR1髓系或淋巴系肿瘤成人患者!
2022 年8月26日,美国食品药品监督管理局(FDA)批准将pemigatinib(Pemazyre,派美替尼)用于治疗带有成纤维细胞生长因子受体1(FGFR1)重组或重排的复发或难治性髓系性/淋巴样肿瘤(MLN)的成人患者[26]。
↓ 点击下图了解更多 ↓

此次Pemazyre获批的新适应证是基于2期FIGHT-203试验(NCT03011372)的结果。试验纳入了28名具有FGFR1重排的复发或难治性MLN患者,检验Pemazyre(派美替尼)的安全性和有效性。
研究结果[26]显示:
- 在18例伴或不伴髓外疾病(EMD)的患者中,14例达到完全缓解(CR)(78%;95%CI:52,94)。CR的中位时间为104天(范围为44至435)。未达到中位持续时间(范围:1+至988+天)。
- 在4例伴或不伴EMD的骨髓急变期患者中,2例达到CR(持续时间:1+和94天)。
- 在3例仅EMD患者中,有1例达到CR(持续时间:64+天)。
- 对于所有28例患者(包括3例无形态学疾病证据的患者),完全细胞遗传学反应率为79%(22/28;95%CI:59,92)。
霍奇金淋巴瘤
● 高危儿童霍奇金淋巴瘤,迎来一线ADC疗法!
2022年11月10日,美国食品药品监督管理局(FDA)批准brentuximab vedotin(Adcetris)联合使用阿霉素、长春新碱、依托泊苷、泼尼松和环磷酰胺,用于2岁及以上既往未经治疗的高风险经典霍奇金淋巴瘤(cHL)儿科患者。这是brentuximab vedotin的首个儿科批准[27]。
Adcetris是一种抗体偶联药物(ADC),由靶向CD30蛋白的一种单克隆抗体和一种微管破坏剂(MMAE)通过一种蛋白酶敏感的交联剂偶联而成。
↓ 点击下图了解更多 ↓

此次批准是基于一项III期AHOD1331研究的结果,该研究共纳入600名患者,旨在评估Adcetris联合化疗在青少年cHL(2-21岁)患者中的疗效。
研究结果[27]显示与标准治疗方案【多柔比星(A)、长春新碱(V)、依托泊苷(E)、泼尼松(P)和环磷酰胺(C)】相比,添加ADC药物到AVEPC中可显著提高无事件生存期(EFS)。
在更新迭代的时代,肿瘤药物不断推陈出新,为患者们带来了新的选择与希望,大幅度提高了患者的远期生存率。新药研发也一直是血液肿瘤领域中最受瞩目的重点,我们期待在新的一年有更多新疗法、新药物获批,为血液肿瘤患者带来福音!
参考文献
[1]http://www.e-cspc.com/details/details_92_4551.html
[2]http://www.e-cspc.com/details/details_92_4580.html
[3]https://www.cstonepharma.com/html/news/3062.html
[4]https://sseir.beigene.com/news/baijishenzhouxuanbubeilituo-zhusheyongbeilintuooudankang-zaizhongguohuopiyongyuzhiliaoertongfufahuonanzhixingqiantibxibaojixinglinbaxibaobaixuebing/3c107bb4-fe72-43f4-97bd-2739ed7a67fb/
[5]http://nccn.medlive.cn
[6]中国临床肿瘤学会(CSCO)儿童及青少年白血病诊疗指南(2022版).
[7]李氏大药厂新闻稿.
https://www.leespharm.com/wp-content/uploads/2022/07/20.05.2022-%E6%96%B0%E4%BA%A7%E5%93%81Natulan-%E5%8F%96%E5%BE%97%E8%8D%AF%E5%93%81%E6%B3%A8%E5%86%8C%E8%AE%B8%E5%8F%AF%E8%AF%81.pdf
[8]https://mp.weixin.qq.com/s/207RyqZMzf4rBc4nfH09uQ
[9]http://www.sinocelltech.com/Detail/desc/pid/23/sid/363.html
[10]Yuankai Shi,Qingyuan Zhang,Xiaonan Hong,et al.Hematol Oncol.2022 Jul 20.
[11]https://www.nmpa.gov.cn/datasearch/search-info.html?nmpa=aWQ9ZmFjMDJjNjM1NzJhNzkyYmVmZWYxOGNlOGRlNGYzYTImaXRlbUlkPWZmODA4MDgxODNjYWQ3NTAwMTg0MDg4NjY1NzExODAw
[12]Kim YH,Bagot M,Pinter-Brown L,et al.Mogamulizumab versus vorinostat in previously treated cutaneous T-cell lymphoma (MAVORIC): an international, open-label, randomised, controlled phase 3 trial. Lancet Oncol. 2018 Sep;19(9):1192-1204.
[13]http://www.e-cspc.com/details/details_92_4609.html
[14]http://www.e-cspc.com/details/details_92_4814.html
[15]https://www.nmpa.gov.cn/yaopin/ypjgdt/20221109161704108.html
[16]Lugui Qiu et al.2022EHA.Abstract 1119.
[17]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-ciltacabtagene-autoleucel-relapsed-or-refractory-multiple-myeloma
[18]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-teclistamab-cqyv-relapsed-or-refractory-multiple-myeloma
[19]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-axicabtagene-ciloleucel-second-line-treatment-large-b-cell-lymphoma
[20]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-lisocabtagene-maraleucel-second-line-treatment-large-b-cell-lymphoma
[21]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-azacitidine-newly-diagnosed-juvenile-myelomonocytic-leukemia
[22]毛声巧,陈静.幼年型粒单核细胞白血病分子特征及诊疗进展[J].中华儿科杂志,2022,60(10):1085-1088.
[23]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-ivosidenib-combination-azacitidine-newly-diagnosed-acute-myeloid-leukemia
[24]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-olutasidenib-relapsed-or-refractory-acute-myeloid-leukemia-susceptible-idh1-mutation
[25]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-tisagenlecleucel-relapsed-or-refractory-follicular-lymphoma
[26]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pemigatinib-relapsed-or-refractory-myeloidlymphoid-neoplasms-fgfr1-rearrangement
[27]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-brentuximab-vedotin-combination-chemotherapy-pediatric-patients-classical-hodgkin
[28]封面图源:http://freepik.com
捷信医药·找药神器原创稿件,请勿转载。 |
|