|
|
免疫系统是对抗癌症的主要防线,而T细胞在肿瘤免疫监控中起着主要作用。肿瘤细胞已被证明可以逃逸肿瘤反应性T细胞的杀伤,部分原因是由于肿瘤微环境(TME)的免疫抑制特性。近年来,免疫检查点抑制剂(ICB)成为一种极具潜力的治疗选择用于克服免疫抑制。
靶向CTLA-4、PD-1和 PD-L1的经典ICB已证实在多种肿瘤类型中显示了出众的有效性和持久的应答。然而,由于各种不同的耐药机制,许多患者未能产生应答。预后和对ICB的应答取决于TME的组成、肿瘤细胞的免疫原性和免疫细胞的浸润程度,这些也是决定联合治疗能否有效克服ICB耐药的关键因素。
TME主要被分为热肿瘤、冷肿瘤、免疫抑制和免疫排斥四类,改善免疫治疗的效果需要针对TME中不同类型的免疫环境进行量身定做组合策略。本文我们就过去三年克服不同TME类型耐药的联合治疗的最新进展和新策略,做一个简要介绍(图1)。
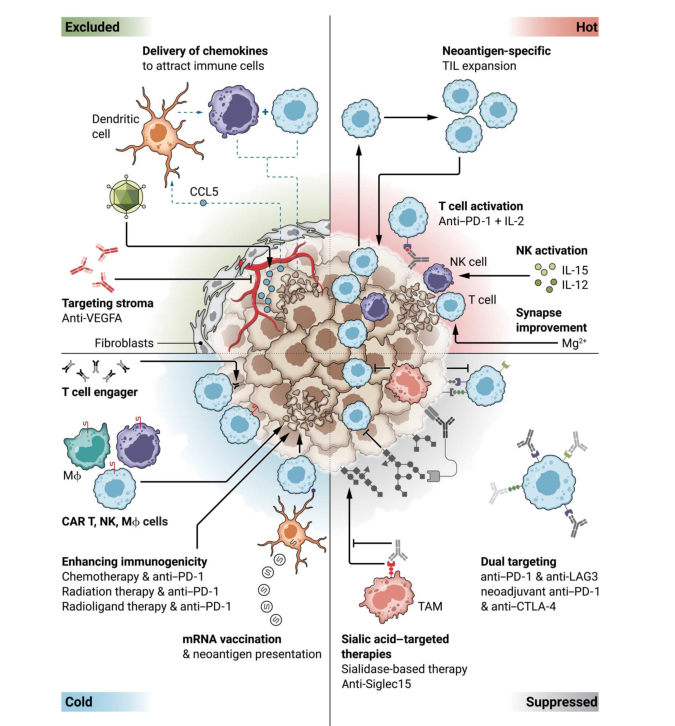
图1. 联合免疫疗法以应对不同类型的肿瘤微环境
热肿瘤
“热”肿瘤的特征是T细胞高度浸润、PD-L1表达、高肿瘤突变负荷和IFN-γ信号增强。T细胞高度浸润部分归因于肿瘤内趋化因子的存在,包括CCL5、CXCL9和CXCL10,这些趋化因子有利于T细胞向肿瘤内的招募。尽管T细胞能够侵袭热肿瘤,但它们的作用可能受到多种机制的抑制,包括肿瘤抗原处理缺陷,肿瘤固有的信号转导途径,如经典的Wnt/β-Catenin途径,以及TME中的多种细胞和非细胞免疫抑制机制,包括T细胞耗竭。高度浸润性TME与晚期疾病患者对ICB的反应改善有关。
在过去的几年里,ICB已经成功地被开发,甚至作为黑色素瘤、膀胱癌和肺癌患者的辅助治疗。此外,越来越多的临床试验进一步证明了新辅助(手术前)ICB作为单一治疗或与化疗联合应用的有效性。在晚期黑色素瘤患者中,发现联合阻断CTLA-4和PD-1的病理完全反应可以预测黑色素瘤患者的无复发生存率。最近一项针对黑色素瘤患者的临床研究表明,与辅助Keytruda相比,新辅助Keytruda可提高无复发生存率(NCT03698019)。另外一项研究分析表明,三级淋巴结构(TLS)的存在预测了膀胱癌患者在接受联合PD-L1和抗CTLA4抗体的新辅助治疗下的病理反应和无复发生存率。
另一种可能增加肿瘤内T细胞数量和功能的策略是体外扩增和过继细胞转移(TIL-ACT)。TIL-ACT在包括黑色素瘤和NSCLC在内的转移性疾病患者中显示出持久的应答率。最近的分析表明,干细胞样的CD39−CD8T细胞对黑色素瘤患者的肿瘤消退起主导作用。因此富集更强大的T细胞亚群,以及选择扩增肿瘤抗原或新抗原特异性T细胞都可以改善TIL-ACT得治疗效果。
联合其他免疫治疗可进一步改善TIL-ACT。最近的一项I期试验报告了TIL-ACT和PD-1阻断的联合应用对NSCLC患者的良好的安全性和优异的的疗效。特别是针对带有驱动突变的患者,例如, EGFR改变。尽管ICB对高TMB肿瘤的疗效有所改善,但一些患者仍然对治疗没有足够的反应。耐药机制包括在IFN-γ反应途径或抗原处理和提呈途径的突变。虽然这能够使肿瘤逃脱T细胞的清除,但这可导致NK细胞的识别率提高。因此,用激活NK细胞的细胞因子(包括IL-12和IL-15)可以为患有MHC 缺陷型肿瘤提供治疗益处。
目前正在多次临床试验中进行研究。例如,IL15超级激动剂N-803对卡介苗(BCG)无反应的非肌肉浸润性膀胱癌显示出良好的治疗活性,与BCG联合应用时,完全缓解率>70%,膀胱切除避免率>90%。即使在具有T细胞高度浸润的MHC+的肿瘤中,由于TME中缺乏游离镁,也可能发生耐药。最近的一项研究表明, LFA-1是与肿瘤细胞形成免疫突触的关键整合素,需要镁来稳定其在T细胞上的活性构象。血清中镁浓度过低在临床上与ICB治疗患者的快速疾病进展和较短的存活率相关。临床前数据已经证实镁和LFA-1都可以作为治疗靶点,特别是与PD-1阻断联合使用。
免疫抑制肿瘤
“免疫抑制”肿瘤表现为中等数量的浸润性T细胞,但TME中,尽管没有物理屏障,但它限制了免疫细胞的激活和进一步招募。肿瘤细胞通常通过几种机制来逃逸免疫细胞的杀伤,如释放IL-10和TGF-β,或募集肿瘤相关巨噬细胞(TAM)。在这些肿瘤中,避免对经典PD-(L)1定向免疫治疗的耐药性的一种选择可能是针对TME内的替代抑制途径,包括LAG3和TIGIT。LAG3和TIGIT是已知的抑制受体,可防止自身免疫的发生。肿瘤中持续的抗原暴露会导致免疫细胞上这些受体的持续共表达,从而导致功能受抑。
在多种体内模型中,单独抑制这些受体只提供微弱的反应,而加上PD-1的双重阻断可导致T细胞耗竭减少和抗肿瘤免疫力提高。与未经治疗的晚期黑色素瘤患者相比,nivolumab和relatlimab(LAG3阻断抗体)的组合显示出比单独使用nivolumab更好的临床益处,最近也已被批准上市。
癌细胞代谢会消耗TME中免疫细胞必需的营养物质,并通过包括犬尿氨酸、腺苷或乳酸在内的代谢物的积累进一步抑制免疫细胞的功能。在过去的几年里,代谢免疫逃避机制被发现,这使得研究人员能够中和代谢抑制的TME,例如通过抑制肿瘤相关的蛋氨酸转运体SLC43A2,或通过PRODH2的过度表达来加强CAR T细胞中的脯氨酸生物合成。
冷肿瘤
“冷”瘤的特点是低T细胞浸润、低TMB、低MHC表达和低PD-L1表达。免疫渗透的缺乏阻碍了免疫疗法的效果,因此需要开发新的组合策略来实现相关的治疗效益。CAR T细胞疗法有望针对更大范围的肿瘤,即使它们缺乏足够的内源性T细胞渗透。由于冷肿瘤可以被巨噬细胞穿透,最近的临床试验研究了人巨噬细胞与CAR的结合,以利用它们对肿瘤的吞噬活性。
这些CAR巨噬细胞(CAR-M)在人源化小鼠模型中表现出抗原特异性的肿瘤吞噬作用,诱导促炎TME,并增强T细胞的抗肿瘤活性。因此,这些发现支持CAR-M疗法作为一种潜在的治疗选择来诱导抗肿瘤免疫应答。除了巨噬细胞外,NK细胞也被开发做为工程化免疫细胞的来源。CAR NK细胞可以避免对自体来源的需求,其制造具有多种来源选择,包括健康捐赠者、脐带血或诱导的多能干细胞。
临床前和I/II期试验表明,异体CAR NK细胞输注是可行的,移植物抗宿主病的风险较低。新出现的证据表明,只有少数肿瘤内的T细胞识别与癌症相关的抗原,但“旁观者”T细胞很多。因此,另一种增强抗肿瘤反应的选择是使用识别肿瘤细胞的双特异性抗体来吸引T细胞,从而产生对癌细胞的杀伤作用。最近,tebentafusp,一种双特异性gp100肽-HLA靶向的CD3 T细胞结合蛋白,提高了患者的存活率,并已被批准用于HLA-A*02:01阳性的无法切除或转移性葡萄膜黑色素瘤的成人患者。
这种疗法证实了在实体肿瘤中的潜力。但也已经被描述了具有各种耐药机制,包括上调免疫检查点、抗原丢失或免疫抑制因子。因而,联合应用ICB可能会克服这种治疗的耐药性。mRNA疫苗是癌症免疫治疗的另一个有潜力的平台,因为它们能够使肿瘤抗原在APC上表达,同时也刺激免疫反应。以前,mRNA疫苗受到不稳定、天然免疫原性和低效递送的限制。然而,随着化学成分的优化和递送策略的改进,这些瓶颈得到了实质性的改善。COVID-19的大流行极大地加快了mRNA疫苗的临床测试和应用。
BioNTech目前正在进行一项开放标签随机试验(NCT04526899),研究其候选癌症疫苗BNT111与PD-1单抗cemiplimab的联合治疗。同样,Moderna目前正在Keynote-942 II期试验(NCT03897881)中测试了其个性化癌症疫苗mRNA-4157与K药的组合。12月13日, Moderna公司宣布, mRNA-4157与K药的组合在黑色素瘤患者中到达了具有统计学意义的临床终点。
与单独使用K药相比,使用mRNA-4157 +K药的联合治疗能够使得患者黑色素瘤复发或死亡的风险降低了44%。这些试验结果为癌症患者的mRNA疫苗疗法铺平道路。另外在过去的几年里,一些肿瘤靶向的ADCs已经被批准,并且与检查点抑制剂进行联合治疗,但其潜在协同作用尚未得到临床证实。同样,肿瘤靶向放射性寡核苷酸Lu-PSMA-617最近被批准用于治疗转移性去势抵抗前列腺癌,由于其包括诱导ICD在内的几个机制,与PD-1抗体的联合治疗目前正在进行II期临床试验(NCT03805594) ,以评估潜在的协同作用。
免疫排斥
在免疫 “排斥”的肿瘤中,T细胞和其他效应细胞在侵袭边缘聚集,但不能有效地渗透到肿瘤中。肿瘤细胞形成基质屏障,促进血管生成,并嵌入免疫抑制的TME中,包括缺氧和代谢衰竭。免疫 “排斥”的肿瘤通常含有几种促血管生成生长因子,包括VEGFA,它们促进免疫抑制细胞和功能障碍的血管的聚集,同时限制T细胞的渗透。在过去的几年里,几种针对血管生成的酪氨酸激酶抑制剂的免疫联合治疗在肾癌、肝细胞癌和非小细胞肺癌方面显示出显著的益处,并获得品准上市。
肿瘤硬度和胶原蛋白密度是免疫 “排斥”肿瘤的重要组成部分。在过去的几年中,实验证据强调,抑制胶原的稳定性和胶原沉积可以改善T细胞的渗透和增加抗PD-(L)1治疗的应答。除了物理屏障外,缺乏免疫细胞募集趋化因子的TME可以阻碍抗肿瘤免疫反应。最新研究发现,在PD-1阻断后,产生CCL5的肿瘤内NK细胞亚群有助于肿瘤控制或者在肿瘤模型中递送IL-12。
此外,在患者中发现CCL5表达的数量与肿瘤内NK细胞的丰度以及ICB临床疗效正相关。同样,使用溶瘤病毒将CCL5基因导入肿瘤可诱导NK细胞依赖的抗肿瘤免疫。这些发现为未来的临床试验在免疫 “排斥”的肿瘤中测试趋化因子与检查点抑制剂或其他免疫疗法的组合提供了理论基础。
表观遗传失调是肿瘤细胞通过沉默MHC表达或细胞因子信号基因来逃逸免疫识别的另一种机制。例如,ARID1A中的突变可能抑制EZH2介导的IFN信号传导和趋化因子的分泌,从而抑制了ICB的效力。根据这些发现,DNA甲基转移酶抑制剂和组蛋白脱乙酰基酶HDAC家族在内的表观遗传调节剂与免疫疗法的联合治疗正在进行多项临床实验。
小编小结
在过去的几年里,癌症免疫疗法取得了长足的发展,最近FDA批准的药物扩大了实体肿瘤患者的治疗选择。FDA批准的这些药物主要包括PD-(L)-1抗体的新适应症的治疗或与化疗或酪氨酸激酶抑制剂的联合治疗。下一代免疫检查点抑制剂或免疫调节剂尽管在转化研究和早期临床试验方面取得了一定的实质性进展,但批准的还相对较少。
鉴于越来越多的证据表明,抗肿瘤药物能够通过直接作用于肿瘤细胞或介导免疫细胞的非靶点效应来增强抗肿瘤免疫,肿瘤靶向药物如ADC和放射性配体与ICB的潜在协同作用正在进行广泛的临床研究。近日Moderna和默沙东宣布mRNA肿瘤疫苗mRNA-4157联合Keytruda治疗黑色素瘤的临床实验达到主要终点,更是开辟了联合治疗的新时代。未来几年,非ICB的药物,包括mRNA疫苗、溶瘤病毒、细胞因子和趋化因子等将大有可为,我们期待着这一系列的临床试验结果。
参考文献
1.Combination cancer immunotherapies: Emerging treatment strategies adapted to the tumor microenvironment.
2.Next generation of immune checkpoint inhibitors and beyond.
3.Approaches to treat immune hot, altered and cold tumours with combination immunotherapies.
FYI:总结生物医药更多知识点,敬请关注公众平台「佰傲谷BioValley」
部分图源网络,侵权联删 |
|