|
|
单一的生物标志物不足以确定哪些胃癌患者有可能从抗PD-1/PD-L1治疗中获益,这可能是由于肿瘤微环境的复杂性。肿瘤组织中浸润大量的免疫细胞(TIIC),其可以用作肿瘤治疗效果的预测对象。目前关于肿瘤浸润免疫细胞的密度和空间组织的预测价值尚未确定。
基于此,北京大学沈琳教授团队使用多重免疫组化技术在80例胃癌患者中以亚细胞分辨率定量原位生物标志物。为了预测免疫治疗的反应,通过CD4+FoxP3−PD-L1+、CD8+PD-1−LAG3−和CD68+STING+细胞的密度以及CD8+PD-1+LAG3−T细胞的空间组织,建立了一个多维的TIIC标记。TIIC标志可以预测胃癌患者对抗PD-1/PD-L1免疫治疗的反应和患者生存期。相关工作以“Predicting response to immunotherapy in gastric cancer via multi-dimensional analyses of the tumour immune microenvironment”为题于2022年8月18日发表在“Nature Communication”上。
为了研究胃癌标本中TIICs的现象,作者通过m-IHC染色对80份全面福尔马林固定石蜡包埋(FFPE)标本中免疫细胞的密度和空间位置进行了定量分析;对16种蛋白的亚细胞表达进行多重测定。首先是苏木精和伊红(H&E)染色的组织切片由两位病理学家来识别肿瘤核心(TC)、浸润边界(IM)和瘤周正常(N)区域,作者称之为感兴趣区域。所有患者共成像6488个高能场(TC: 4477, IM: 993, N: 1018)。使用监督图像分析系统(inForm)基于机器学习将每张图像分类为肿瘤巢区和基质区。细胞分裂显示细胞核、细胞质和膜轮廓。细胞表型数据是根据一个面板上所有标记的阳性和相对强度获得的。计算“所有”区域的细胞密度(肿瘤+间质),分别在肿瘤和间质中测量。随后,在单细胞水平对TIICs进行分析,并对26个主要种群进行了特征描述。
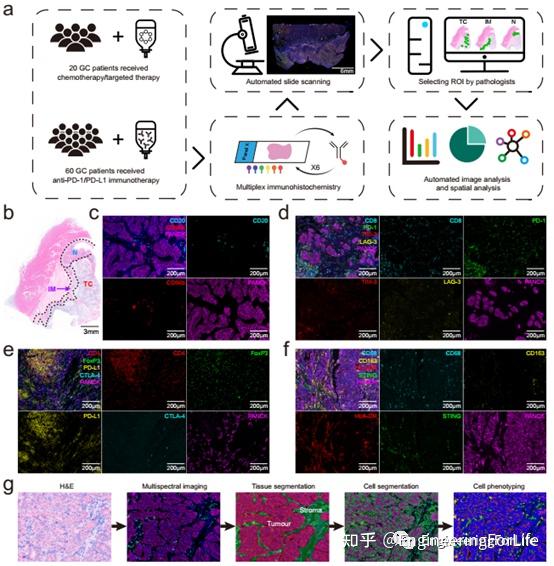
图1 胃癌组织中浸润性免疫细胞的鉴定与表征。a本研究的实验设计和分析方法的示意图。b选择感兴趣的区域(ROIs)在苏木精和伊红(H&E)染色的甲醛固定石蜡包埋组织图像。c-f使用的多重免疫组化板的代表性复合和单染色图像。g自动图像分析流水线概述。
为了研究TIICs在肿瘤微环境中的分布,作者分析了它们在TC、IM和N区的空间密度。与相邻正常组织相比,TC内CD68+细胞总体密度明显增加;CD8+和CD20+细胞则相反。为了更详细地探讨各个TIIC的分布,CD8+、CD8+PD-1−LAG-3−、CD20+、CD68+CD163+HLA-DR−细胞在IM处聚集,向TC处减少。相比之下, CD8 + PD-1 + TIM-3 +、CD8 + PD-1−TIM3 +、CD8 + PD-1 + LAG-3 + TIM-3 +、CD8 + PD -1 + LAG-3−TIM-3 +、CD4 + FoxP3 + CTLA-4 +, CD4 + FoxP3−CTLA-4 + CD68 +, CD68+HLA-DR+CD163−细胞在TC处聚集,向IM处减少。有趣的是,CD4+FoxP3+和TC中CD4+FoxP3+PD-L1+细胞较正常组织多见,可见GC中TIICs的异质性分布。为了评估GC中的肿瘤免疫微环境,作者比较了不同临床病理因素下的TIICs密度。
此外,HER2阳性和阴性患者的TIICs密度差异不大GC。总的来说,CD8+、CD4+和CD68+细胞的总密度与疾病的分期有关。此外,GC晚期(III-IV)样品显示出更高的CD8+ T细胞密度,CD4+FoxP3−细胞等。有趣的是,EBV阳性肿瘤中CD8+PD-1−LAG-3−T细胞的密度高于EBV阴性肿瘤。EBV (+) gc具有丰富的特征免疫细胞浸润;然而,并不是所有的EBV(+)患者都对免疫治疗有反应,这表明需要特异性的免疫细胞浸润。熟练MMR (pMMR)肿瘤中CD4+、CD68+、CD20+和CD66b+细胞的丰度显著高于dMMR肿瘤。在一些癌症中,较高的CD68+和CD66b+细胞(中性粒细胞)有助于PD-1/PD-L1治疗的耐药性。结果表明,免疫细胞的浸润模式依赖于但不限于GC分子亚型。发现较高水平的肿瘤浸润T细胞亚群,包括CD8+PD-1+LAG-3+TIM-3+,在80例患者中,CD4+FoxP3+CTLA-4+ T和CD68+STING+细胞与总生存期(OS)较低相关。数据显示CD4+FoxP3−CTLA-4+ T细胞和CD4+FoxP3+CTLA-4+ T细胞在两种情况下都有类似的趋势。CD8+PD-1+LAG-3+TIM-浸润率较高与较差的肿瘤巢OS相关。这些结果凸显了研究特定组织区域内免疫细胞密度的价值。
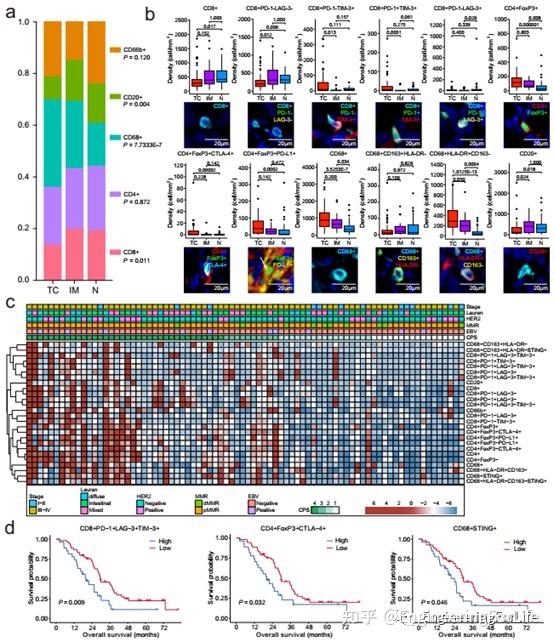
图2 自动图像分析突出了胃癌中有序的免疫成分。a主要肿瘤浸润性免疫细胞(TIIC)群体的构成。b各感兴趣区域的TIICs密度(n = 80)。TC,肿瘤的核心;IM,入侵保证金;N,正常组织。c按亚型分组的TIIC密度。d基于TIICs密度的80例患者的总生存期。
作者输出特征的重要性和每个参数的平均值来表示其贡献。CD8+PD-1+LAG-3−细胞的有效评分比CD68+STING+的密度具有更高的特征重要性,ETC、GBC和ABC机器学习模型中CD4+FoxP3−PD-L1+或CD8+PD-1−LAG-3−细胞的有效得分如图所示,CD8+PD-1+LAG-3−细胞的特征重要性高于EBV、MMR和PD-L1 CPS三种免疫细胞类型。因此,主要的预测标记是免疫治疗反应的空间组织。接下来,作者研究了TIIC信号的预后作用;采用单因素Cox比例风险回归模型计算各指标的HR。然后,作者用各指标的HR作为权重,乘以指标本身的值,然后计算出四个指标的加权和。在这个分析中,作者根据TIIC签名将患者分为高分和低分组。使用Kaplan-Meier方法计算各组间存活概率随时间的差异。正如预期的那样,作者观察到验证队列中免疫相关无进展生存期(irPFS)和免疫相关总生存期(irOS)存在显著差异。因此,TIIC信号可能有助于识别那些预先表现出积极的抗肿瘤免疫反应的患者。
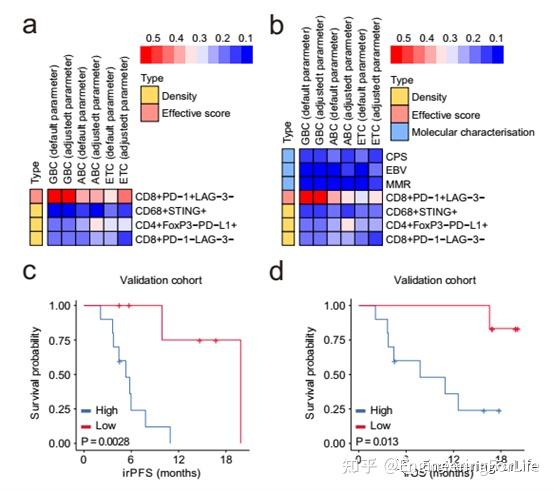
图3 TIIC特征和预测的免疫相关生存期间关系。a, b预测模型中每个标记点的特征重要性。c, d免疫相关无进展生存期(irPFS)和免疫相关总生存期的Kaplan-Meier曲线。抗PD -1/ PD - L1免疫相关的生存期(irOS)与肿瘤浸润免疫细胞(TIIC)的相关性,采用Log-rank (Mantel-Cox)检验分析。
总而言之,作者的结果强调了肿瘤免疫浸润的多维标记评价作为一个强大的和定量的胃癌预测工具。胃癌样品的微环境组成的探索将提供与肿瘤进展和免疫治疗反应相关的复杂和异质性免疫联系的关键见解。
文章来源: |
|