|
|
肿瘤PDT是药械联合的消融治疗方案,独特的机制原理使其不同于常规消融治疗,具有双靶向、更精准、有效率更高正常组织损伤更小的优势。
肿瘤光动力疗法(PDT,Photodynamic Therapy),是一种有氧分子参与的伴随生物效应的光化学反应,其过程为特定波长的激光照射使组织吸收的光敏剂受到激发,氧分子通过能量传递,产生氧自由基和单态氧等活性氧,产生细胞毒性作用,从而导致肿瘤细胞受损乃至死亡。
血卟啉衍生物(HpD)通过脂质通路靶向聚集肿瘤细胞,在光化学条件下产生细胞毒性物质,精准高效作用于肿瘤细胞。
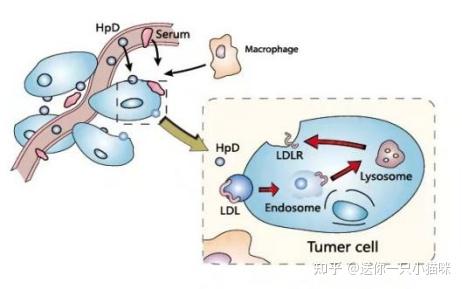
HpD靶向富集到肿瘤细胞
1.亲脂性卟啉在血液中主要由低密度脂蛋白(LDL)携带进入细胞,肿瘤细胞中的LDL受体数目远远多于正常细胞中的数目,由LDL携带的卟啉在肿瘤细胞中的量或停留时间较正常细胞大,而使肿瘤细胞积累PpIX;
2.与肿瘤细胞间质中的PH值较低有关[1],肿瘤细胞的无氧代谢决定肿瘤微环境的低PH,易于PpIX的积累;
3.人类翻译延伸因子eEF1A1在肿瘤细胞中的表达量高于正常细胞,eEF1A1通过与PpIX结合,阻止了 PpIX的降解或转化,从而造成了肿瘤细胞中PpIX的积累[2-3]。
HpD经过光能跃迁后发生光化学反应,产生细胞毒性物质。

HpD的两种光化学反应
1.光敏剂在光吸收后从S0基态进入T1激发三重态,光敏剂三重态T1非常活跃,发生I型和II型光化学反应;
2.Ⅰ型反应产生的氧自由基与含O的底物发生反应,产生ROS(活性氧物质)诱导氧化应激,导致癌细胞的破坏;
3.Ⅱ型反应产生的1O2会氧化并对细胞的质膜、线粒体、溶酶体和细胞核造成损伤,导致肿瘤坏死;
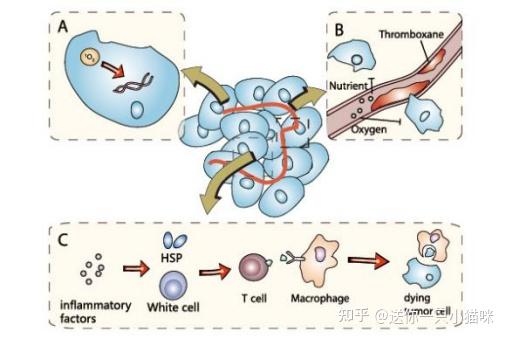
靶向细胞毒性和免疫应答破坏病变组织
4.肿瘤PDT治疗后,免疫细胞和免疫相关分子显著增多,上调机体免疫应答[4]。
HpD也通过作用于肿瘤血管及内皮细胞得破坏作用发生抗肿瘤效应。
有研究提示除肿瘤细胞直接死亡以外,肿瘤血管也是一个重要目标,卟啉与肿瘤周围的结缔组织有强烈的亲合力,血卟啉在肿瘤组织中主要与血管基质和巨噬细胞结合,血管基质中的血卟啉含量很高,使肿瘤组织中的微血管出现弥漫性损伤,造成肿瘤内血液循环受阻,因此受损的微血管不能供给肿瘤必要的营养,肿瘤生长被抑制从而导致死亡。PDT损伤血管的部位可能包括微血管内皮细胞和内皮细胞胶原蛋白基质,最大的可能性是血管及细胞同时受损[5-6]。
参考文献:
[1] 许德余. 肿瘤光动力疗法[M]. 中国医药科技出版社, 1996.
[2] 崔晓君. eEF1A1对光动力治疗中光敏剂PpIX在肿瘤细胞内富集的作用机制研究. 复旦大学, 2013.
[3] Av A , Nb A , Ym A , et al. From molecules to nanovectors: current state of the art and applications of photosensitizers in photodynamic therapy[J]. International Journal of Pharmaceutics, 2021.
[4] Long S , Zhao Y , Xu Y , et al. Immune response induced by hematoporphyrin derivatives mediated photodynamic therapy: Immunogenic cell death and elevated costimulatory molecules[J]. Journal of Innovative Optical Health Sciences, 2022, 15(4):2240002.
[5] De Vree W , Fontijne-Dorsman A , Koster J , et al. Photodynamic treatment of human endothelial cells promotes the adherence of neutrophils in vitro.[J]. British Journal of Cancer.
[6] Vree W , Essers M C , Bruijn H , et al. Evidence for an important role of neutrophils in the efficacy of photodynamic therapy in vivo.[J]. Cancer Research, 1996, 56(13):2908-2911. |
|