|
|

撰文︱李家劲,吴 朕,谷 皓
责编︱方以一,王思珍
MYC是第一个在肿瘤细胞中被发现扩增的原癌基因,其异常表达参与了肿瘤进展的相关过程。早在1981年,科学家就首次提出病毒启动子的整合可以驱动细胞MYC的表达并导致癌症,而MYC于1982年首次在人类伯基特淋巴瘤中被发现。从那时起,MYC就成为了肿瘤研究领域的热门基因,迄今为止,对这种癌基因的研究仍在进行。从对MYC转录因子功能的研究,到对MYC的转录靶标进行分析,再到对MYC在肿瘤模型中一系列作用的探索,以及当前热点的肿瘤免疫和免疫治疗研究使科学家们逐渐揭开了MYC,特别是其在肿瘤免疫过程中的神秘面纱。癌基因MYC在多种人类癌症中失调,并作为众多癌症相关信号通路的关键汇聚点,在肿瘤及其免疫微环境中发挥着至关重要的作用。
2023年3月25日,安徽医科大学谷皓团队在《细胞死亡发现(Cell Death Discovery)》上发表了题为《MYC对肿瘤免疫和免疫治疗的影响(The effects of MYC on tumor immunity and immunotherapy)》的综述文章。安徽医科大学临床医学“5+3”一体化儿科学专业本科生李家劲和董婷玉为共同第一作者,基础医学院谷皓教授为通讯作者,第一临床医学院临床医学专业本科生吴朕和临床医学“5+3”一体化专业本科生朱达诚参与发表。作者从MYC对肿瘤微环境中多种细胞的调控、MYC介导肿瘤细胞与免疫细胞的联系和靶向MYC的肿瘤免疫治疗三个角度分析了MYC在肿瘤免疫中的关键作用,并对以MYC及其相关信号通路为靶点的肿瘤免疫治疗策略进行了展望。

一、MYC基因简介
Myc基因家族包括三个成员:MYC、MYCN和MYCL[1]。作为Myc家族的一员,MYC是一种重要的原癌基因,它可以作为转录调节因子在多种人类肿瘤中表达。MYC基因定位于人类8号染色体,其羧基末端包含b-HLH-Zip结构域,该结构域与MYC相关因子X(MAX)结合;这些结构域可以与基因启动子上的E盒(E-box)结合并启动相应基因的转录。MYC的靶基因调控广泛的生物学功能,包括细胞增殖、分化和免疫监视等[1]。因此, MYC信号通路被认为是癌症治疗的潜在靶点。此外,越来越多的证据表明MYC过度激活可以在多个水平上介导肿瘤的免疫抑制[2]。尽管MYC相关的免疫疗法面临诸多挑战,但近年来持续的重大突破使科学家对靶向MYC治疗癌症有了坚定的信心。毫无疑问,深入了解MYC基因家族在肿瘤免疫中的作用和机制,对于开发有效的癌症治疗方法至关重要。
二、MYC驱动的肿瘤免疫抑制
肿瘤微环境的组成主要包括肿瘤细胞、肿瘤浸润免疫细胞、平滑肌细胞、内皮细胞和癌相关基质细胞等[3]。肿瘤细胞中的MYC依赖性途径可以间接影响细胞因子在肿瘤微环境中的表达。在肿瘤细胞中,其他信号通路通常与MYC相互作用,为肿瘤进展提供强有力的支持,尤其是WNT/β-catenin[4]。在免疫细胞中,MYC抑制先天和适应性免疫反应。先天性免疫细胞亚群MYC的过度激活会抑制促炎介质的产生。适应性免疫细胞亚群MYC的过度激活主要通过抑制效应T细胞降低对肿瘤的杀伤作用。在癌相关成纤维细胞(CAFs)中,MYC可以被CAFs中的一些细胞因子激活,从而抑制肿瘤免疫。此外,CAFs可能以旁分泌方式发出信号,以增强肿瘤中MYC的表达,从而驱动肿瘤发生。
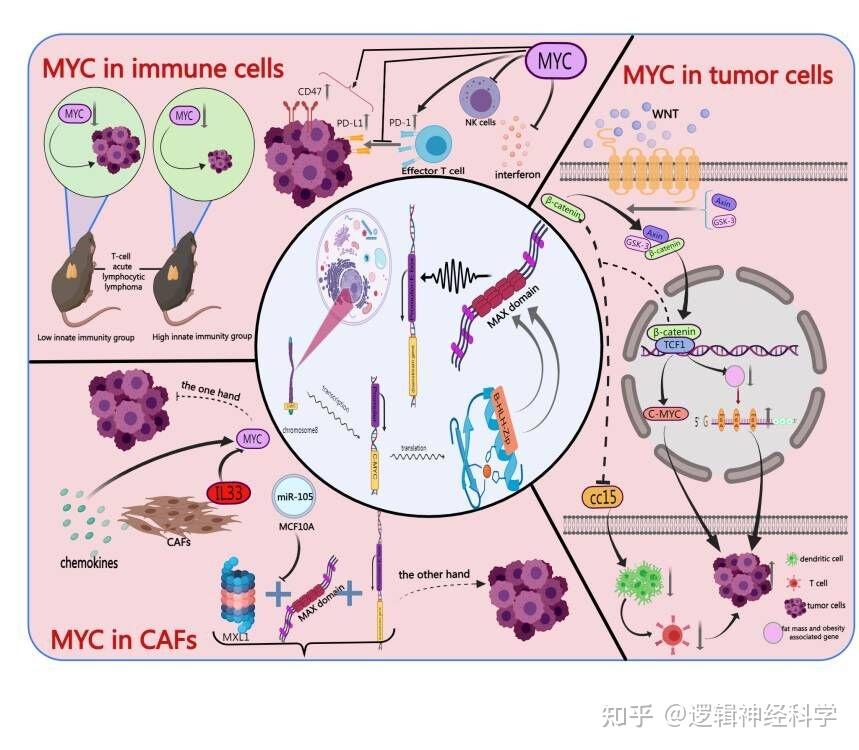
图1. MYC在肿瘤微环境中的功能和机制(图源:Li et al., Cell Death Discovery, 2023)
三、MYC介导肿瘤细胞与免疫细胞相互作用
MYC的过度激活通过肿瘤细胞与不同免疫细胞亚群之间的联系启动肿瘤诱导的免疫抑制。CD8 +T 细胞对于抗肿瘤免疫的建立至关重要,典型的 BRG1/BRM 相关因子 (cBAF) 和 MYC 在活化的 CD8 +T细胞的第一次分裂过程中经常不对称地与两个子细胞共同结合。具有高 MYC 和高 cBAF 的子细胞显示出朝向T(eff) 细胞的细胞命运轨迹[5]。此外,现有研究表明,MYC 是协调 Treg 积累、过渡激活和代谢编程的核心[6]。肿瘤浸润性 B 淋巴细胞 (TIB) 存在于癌症的各个阶段并参与塑造肿瘤的发展。一方面,一些研究表明 TIB 可以诱导和维持抗肿瘤活性。另一方面,也有研究者发现B细胞可能起到促瘤作用。在多种癌症中,肿瘤细胞中激活的 MYC介导避免 NK 细胞的细胞毒性[7]。MYC 是与树突状细胞发育、分化、成熟和代谢的重要转录因子。MYC 在急性髓性白血病和慢性淋巴细胞白血病中过表达,并且能够抑制生物钟基因 Period2的表达,该基因在中性粒细胞中高度表达,从而增强抗肿瘤增殖[8]。
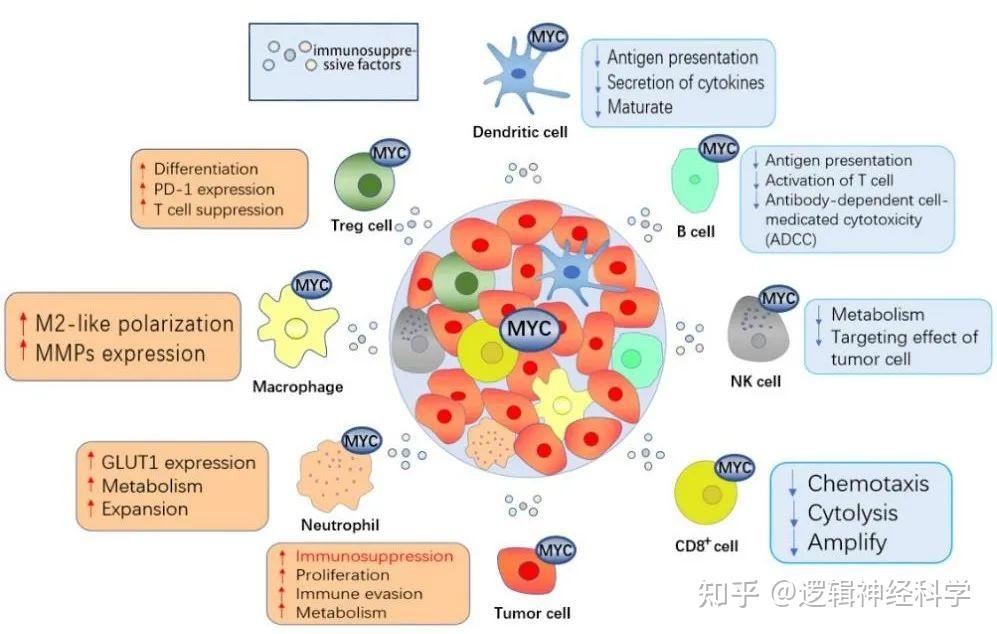
图2. MYC在肿瘤微环境中引起免疫抑制(图源:Li et al., Cell Death Discovery, 2023)
四、靶向MYC的肿瘤免疫治疗
许多潜在的策略已经被开发用于直接或间接抑制 MYC 蛋白的化合物,但 MYC没有明显的小分子结合口袋[9]。现有的直接靶向肿瘤中MYC的治疗策略主要包括使用BET抑制剂阻断MYC和MAX之间的相互作用,以及稳定MYC启动子中的G-四链体(G4)基序[10]。虽然一些BET抑制剂已进入临床试验,但大多数MYC-MAX抑制剂尚未进入。MYC G4元件在开发具有高特异性和亲和力的荧光探针方面具有重要用途。间接MYC治疗策略包括调节与MYC相关的信号分子的活性,从而削弱其在肿瘤中的表达。与直接靶向MYC治疗相比,尽管许多MYC的间接抑制剂已经在临床试验中进行了测试,但耐药性等问题仍需解决。MYC联合免疫疗法主要包括联合封锁 MYC 和免疫检查点,联合 MYC 抑制剂和 CAR-T、MYC 抑制剂和 MYC 激动剂的组合,已显示出强大的治疗潜力,可以通过不同途径和渠道更充分地抑制和调节肿瘤的生长。
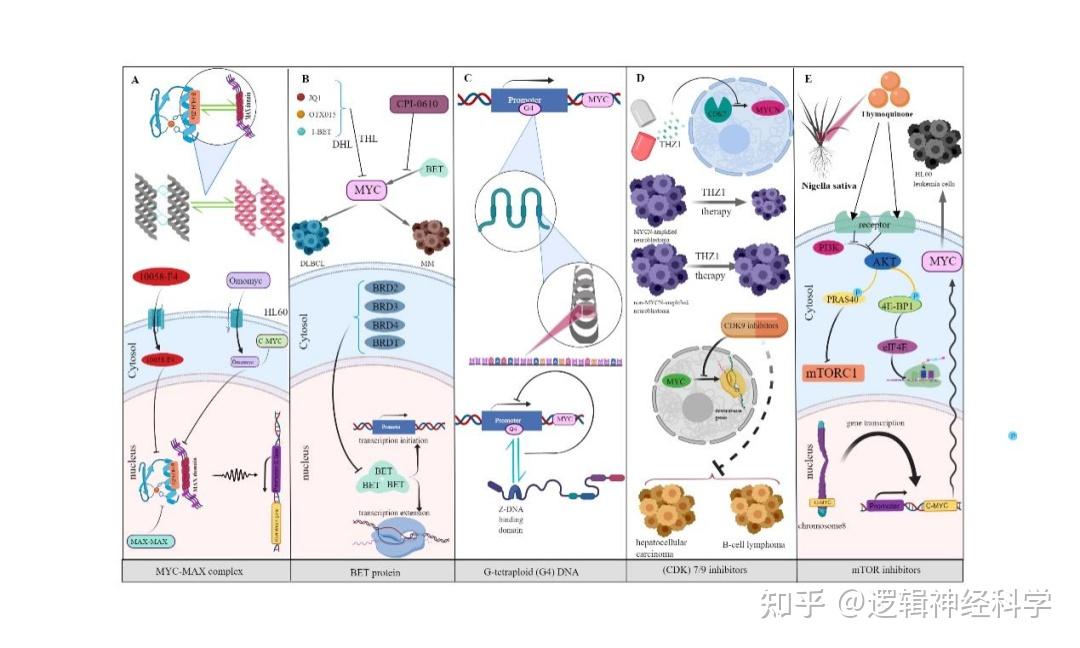
图3. 靶向MYC的肿瘤免疫治疗(图源:Li et al., Cell Death Discovery, 2023)
五、总结与展望
综上所述,大多数人类癌症都有MYC的异常表达而影响肿瘤及其免疫,所以研究和开发作用于MYC的药物是有益的。迄今为止,靶向MYC的免疫治疗策略主要包括抑制MYC的翻译,降低肿瘤中MYC mRNA的稳定性,以及直接或间接抑制MYC活性。此外,为了研究各种癌症的治疗策略并克服肿瘤异质性,研究人员现在正试图建立联合免疫疗法,并在许多早期临床试验中显示出令人鼓舞的结果。尽管科学家们已经取得了巨大的成果,但临床结果还需要进一步验证。总之,针对MYC的治疗策略有助于肿瘤免疫的有机恢复,为癌症免疫治疗提供了新的途径。
原文链接:https://doi.org/10.1038/s41420-023-01403-3

第一作者:李家劲(左);董婷玉(中);通讯作者:谷皓(右)(照片提供自:谷皓团队)
转载须知:“岚翰生命科学”特邀稿件,本内容著作权归作者和“岚翰生命科学”共同所有,欢迎个人转发分享,未经授权禁止转载,违者必究。

参考文献(上下滑动查看) 1. Dang CV: MYC on the path to cancer. Cell 2012, 149(1):22-35.
2. Casey SC, Tong L, Li Y, Do R, Walz S, Fitzgerald KN, Gouw AM, Baylot V, Gutgemann I, Eilers M et al: MYC regulates the antitumor immune response through CD47 and PD-L1. Science 2016, 352(6282):227-231.
3. Azizi E, Carr AJ, Plitas G, Cornish AE, Konopacki C, Prabhakaran S, Nainys J, Wu K, Kiseliovas V, Setty M et al: Single-Cell Map of Diverse Immune Phenotypes in the Breast Tumor Microenvironment. Cell 2018, 174(5):1293-1308 e1236.
4. Bisso A, Filipuzzi M, Gamarra Figueroa GP, Brumana G, Biagioni F, Doni M, Ceccotti G, Tanaskovic N, Morelli MJ, Pendino V et al: Cooperation Between MYC and beta-Catenin in Liver Tumorigenesis Requires Yap/Taz. Hepatology 2020, 72(4):1430-1443.
5. Guo A, Huang H, Zhu Z, Chen MJ, Shi H, Yuan S, Sharma P, Connelly JP, Liedmann S, Dhungana Y et al: cBAF complex components and MYC cooperate early in CD8(+) T cell fate. Nature 2022, 607(7917):135-141.
6. Liston A, Gray DH: Homeostatic control of regulatory T cell diversity. Nat Rev Immunol 2014, 14(3):154-165.
7. Cozar B, Greppi M, Carpentier S, Narni-Mancinelli E, Chiossone L, Vivier E: Tumor-Infiltrating Natural Killer Cells. Cancer Discov 2021, 11(1):34-44.
8. Wang N, Mi M, Wei X, Sun C: Circadian clock gene Period2 suppresses human chronic myeloid leukemia cell proliferation. Exp Ther Med 2020, 20(6):147.
9. Dhanasekaran R, Deutzmann A, Mahauad-Fernandez WD, Hansen AS, Gouw AM, Felsher DW: The MYC oncogene - the grand orchestrator of cancer growth and immune evasion. Nat Rev Clin Oncol 2022, 19(1):23-36.
10. Filippakopoulos P, Qi J, Picaud S, Shen Y, Smith WB, Fedorov O, Morse EM, Keates T, Hickman TT, Felletar I et al: Selective inhibition of BET bromodomains. Nature 2010, 468(7327):1067-1073.
编辑︱杨彬薇
本文完
 |
|